Перхлорат калия (KClO4) – это соединение, содержащее калий, хлор и кислород. Благодаря своим окислительным свойствам он широко используется в пиротехнике и взрывчатых веществах.
| Название ИЮПАК | Перхлорат калия |
| Молекулярная формула | KClO4 |
| Количество CAS | 7778-74-7 |
| Синонимы | Перкаль К, Перхлорат калия, Хлорат калия (VII), ООН 1489 |
| ИнЧИ | InChI=1S/ClHO4.K/c2-1(3,4)5;/h(H,2,3,4,5);/q;+1/p-1 |
Свойства перхлората калия
Формула перхлората калия
Перхлорат калия имеет химическую формулу KClO4, которая указывает на то, что он содержит один атом калия, один атом хлора и четыре атома кислорода. Соединение представляет собой неорганическую соль, которая хорошо растворяется в воде, что делает его полезным окислителем во многих сферах.
Молярная масса перхлората калия
Молярную массу KClO4 рассчитывают путем сложения атомных масс составляющих элементов соединения. Атомные массы калия, хлора и кислорода составляют 39,10 г/моль, 35,45 г/моль и 16,00 г/моль соответственно. Итак, молярная масса KClO4 равна 138,55 г/моль.
Температура кипения перхлората калия
KClO4 не имеет определенной температуры кипения, поскольку он разлагается до достижения точки кипения. При нагревании до высоких температур KClO4 разлагается на хлорид калия и газообразный кислород. Однако было замечено, что соединение может сублимировать при температуре от 400 до 500 °C.
Перхлорат калия Температура плавления
Температура плавления KClO4 составляет около 610°С. При этой температуре твердое соединение переходит в жидкое состояние. Высокая температура плавления KClO4 делает его пригодным для использования в различных отраслях промышленности.
Плотность перхлората калия г/мл
Плотность KClO4 составляет примерно 2,52 г/см³ при комнатной температуре. Это указывает на то, что соединение плотнее воды, плотность которой составляет 1 г/см³. Высокая плотность KClO4 делает его эффективным окислителем в пиротехнике.
Молекулярный вес перхлората калия
Молекулярная масса KClO4 составляет 138,55 г/моль. Эта величина определяется путем сложения атомных масс составляющих элементов соединения. Молекулярная масса KClO4 полезна при определении массы соединения, необходимого для конкретной реакции или процесса.
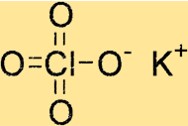
Структура перхлората калия
KClO4 имеет тетрагональную кристаллическую структуру, то есть имеет четырехкратную симметрию вокруг оси c. Кристаллическая решетка соединения состоит из ионов калия, ионов хлора и ионов кислорода, которые удерживаются вместе ионными связями.
Растворимость перхлората калия
KClO4 хорошо растворим в воде, его растворимость составляет около 4,5 г/мл при комнатной температуре. Соединение также растворимо в других полярных растворителях, таких как этанол и ацетон. Однако он нерастворим в неполярных растворителях, таких как бензол и хлороформ. Растворимость KClO4 является важным фактором при его использовании в качестве окислителя в различных промышленных целях.
| Появление | Белое кристаллическое твердое вещество |
| Удельная плотность | 2,52 |
| Цвет | Белый |
| Запах | Без запаха |
| Молярная масса | 138,55 г/моль |
| Плотность | 2,52 г/см³ |
| Точка плавления | 610°С |
| Точка кипения | Разлагается до точки кипения |
| Мигающая точка | Непригодный |
| Растворимость в воде | 4,5 г/мл при 25°C |
| Растворимость | Растворим в этаноле и ацетоне, нерастворим в бензоле и хлороформе. |
| Давление газа | Непригодный |
| Плотность пара | Непригодный |
| пКа | Непригодный |
| рН | Нейтральный |
Безопасность и опасность перхлората калия
KClO4 может представлять угрозу безопасности при неправильном обращении. Соединение является сильным окислителем и может вступать в реакцию с горючими материалами, вызывая пожар или взрыв. Вдыхание пыли или паров KClO4 также может вызвать раздражение дыхательных путей. Длительное воздействие соединения может привести к раздражению кожи или дерматиту. При работе с KClO4 важно использовать соответствующие средства индивидуальной защиты, такие как перчатки, защитные очки и респираторы. Состав также следует хранить в прохладном, сухом месте, вдали от несовместимых материалов и источников тепла и воспламенения.
| Символы опасности | Окислитель |
| Описание безопасности | Хранить вдали от горючих материалов. Носите соответствующие средства индивидуальной защиты. Избегайте вдыхания пыли и паров. |
| Идентификационные номера ООН | ООН1489 |
| код ТН ВЭД | 2829.90.90 |
| Класс опасности | 5.1 – Окисляющие вещества |
| Группа упаковки | II |
| Токсичность | При длительном воздействии может вызвать раздражение кожи или дерматит. Проглатывание или вдыхание соединения может вызвать раздражение дыхательных путей. |
Методы синтеза перхлората калия
KClO4 можно синтезировать различными методами.
Распространенный метод — реакция хлората калия с перхлоратом бария. В результате реакции образуются KClO4 и хлорид бария в качестве побочного продукта, который можно отфильтровать.
Другой метод предполагает реакцию хлората калия с соляной кислотой и хлоридом натрия. В результате реакции образуются KClO4 и хлорат натрия, которые можно разделить кристаллизацией.
Реакция гидроксида калия и перхлората аммония также позволяет синтезировать KClO4. В результате реакции образуются KClO4 и гидроксид аммония, которые можно отделить фильтрованием.
Другой метод предполагает реакцию хлорида калия с перхлоратом натрия в присутствии катализатора. В результате реакции образуются KClO4 и хлорид натрия, которые можно разделить кристаллизацией.
Использование перхлората калия
KClO4 имеет различное применение в разных отраслях промышленности. Некоторые из его распространенных применений:
- Пиротехника: популярный окислитель в пиротехнической промышленности. Используется при изготовлении фейерверков, сигнальных ракет и других видов взрывчатых веществ.
- Ракетные пропеллеры: используется в качестве окислителя при производстве ракетного топлива. Обычно используется в твердотопливных ракетных ускорителях и запусках космических кораблей.
- Инициаторы подушек безопасности: используются в качестве инициатора при производстве подушек безопасности. Для срабатывания подушки безопасности электрический заряд подается через провод, покрытый KClO4. Это вызывает реакцию, в результате которой выделяется газообразный азот, который надувает подушку безопасности.
- Спички: используются при производстве безопасных спичек. Для получения горючего соединения, воспламеняющегося при ударе о шероховатую поверхность, его смешивают с сульфидом сурьмы и серой.
- Гальваника: используется в гальванической промышленности в качестве компонента электролитов, используемых для гальваники металлов.
- Лекарство: используется при лечении заболеваний щитовидной железы, таких как гипертиреоз. Однако его использование в медицине сократилось из соображений безопасности.
- Аналитическая химия: также используется в качестве реагента в аналитической химии для определения некоторых веществ.
Вопросы:
Вопрос: Какие типы связей содержатся в молекуле перхлората калия?
Ответ: KClO4 содержит как ионные, так и ковалентные связи. Ион K+ и ион ClO4- удерживаются вместе ионными связями, а сам перхлорат-ион содержит как ковалентные, так и ионные связи.
Вопрос: Какова формула перхлората калия?
А: КСlO4.
Вопрос: Является ли перхлорат калия водным?
Ответ: KClO4 может растворяться в воде, делая ее водянистой при определенных условиях.
Вопрос: Для чего используется перхлорат калия?
Ответ: KClO4 имеет различные применения, в том числе в фейерверках, ракетных ускорителях и надувных подушках безопасности. Он также используется в аналитической химии в качестве реагента и окислителя.
Вопрос: Как сделать флэш-порошок без перхлората калия?
Ответ: Порошок для вспышки можно приготовить без KClO4 с использованием альтернативных окислителей, таких как перхлорат аммония, перхлорат натрия или пероксид бария.
Вопрос: Какова степень окисления отдельного атома хлора в KClO4?
A: Степень окисления отдельного атома хлора в KClO4 равна +7.
Вопрос: Растворим ли KClO4 в воде?
Ответ: Да, KClO4 растворим в воде.
Вопрос: KClO4 – это кислота или основание?
Ответ: KClO4 не является ни кислотой, ни основанием. Это соль, состоящая из металла (калия) и многоатомного иона (перхлората).
