Сульфит кальция (CaSO3) представляет собой соединение, содержащее ионы Ca2+ и SO32-. Его часто используют в качестве пищевого консерванта, антиоксиданта и очистителя воды из-за его способности удалять примеси и предотвращать порчу.
| Название ИЮПАК | Сульфит кальция |
| Молекулярная формула | CaSO3 |
| Количество CAS | 10257-55-3 |
| Синонимы | сульфит кальция; Сернистая кислота, кальциевая соль; кальций сернистая кислота; кальций сернистая кислота; Е226 |
| ИнЧИ | InChI=1S/Ca.H2O3S/c;1-4(2)3/h;(H2,1,2,3)/q+2;/p-2 |
Свойства сульфита кальция
Формула сульфита кальция
Химическая формула сульфита кальция: CaSO3. Это соединение состоит из иона Ca2+ и иона SO32-. Сульфит кальция можно получить взаимодействием гидроксида кальция с сернистой кислотой. Его широко используют в пищевой промышленности в качестве консерванта и антиоксиданта, а также в качестве очистителя воды.
сульфит кальция Молярная масса
Молярная масса CaSO3 составляет 120,14 г/моль. Это можно рассчитать, сложив атомные массы кальция (40,08 г/моль), серы (32,06 г/моль) и трех атомов кислорода (по 16,00 г/моль каждый).
Температура кипения сульфита кальция
CaSO3 не имеет четко определенной точки кипения, поскольку он разлагается, не достигнув точки кипения. Однако его можно нагреть до температуры около 450°C, прежде чем произойдет разложение. Это связано с тем, что CaSO3 является нестабильным соединением и имеет тенденцию разлагаться на сульфат кальция и диоксид серы при нагревании.
Температура плавления сульфита кальция
Температура плавления CaSO3 составляет около 1520°С. Это температура, при которой твердое соединение переходит в жидкое состояние. CaSO3 имеет кристаллическую структуру и плавится при высоких температурах благодаря прочным ионным связям между кальцием и сульфит-ионами.
Плотность сульфита кальция г/мл
Плотность CaSO3 составляет примерно 2,71 г/мл. Это означает, что один миллилитр CaSO3 имеет массу 2,71 грамма. Высокая плотность CaSO3 обусловлена наличием иона кальция, имеющего большую атомную массу.
Молекулярный вес сульфита кальция
Молекулярная масса CaSO3 составляет 120,14 г/моль. Это можно рассчитать, сложив атомные массы кальция, серы и трех атомов кислорода в соединении. Молекулярная масса CaSO3 важна для определения его физических и химических свойств.
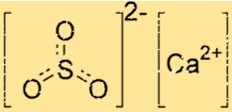
Структура сульфита кальция
Структура CaSO3 состоит из одного иона Ca2+ и одного иона SO32-. Ион кальция окружен шестью атомами кислорода, а сульфит-ион имеет два атома кислорода и один атом серы. Ион Ca2+ и ион SO32- удерживаются вместе ионными связями, которые представляют собой сильные электростатические силы притяжения между противоположно заряженными ионами.
Растворимость сульфита кальция
CaSO3 плохо растворяется в воде, его растворимость составляет около 0,17 г/100 мл при комнатной температуре. Это означает, что лишь небольшое количество CaSO3 может раствориться в воде, а остальные твердые частицы останутся во взвешенном состоянии в воде. На растворимость CaSO3 влияют такие факторы, как температура, pH и присутствие других ионов.
| Появление | Белый порошок или кристаллическое твердое вещество |
| Удельный вес | 2,71 |
| Цвет | Белый |
| Запах | Без запаха |
| Молярная масса | 120,14 г/моль |
| Плотность | 2,71 г/мл |
| Точка плавления | 1520°С |
| Точка кипения | Разлагается до достижения точки кипения |
| Мигающая точка | Непригодный |
| Растворимость в воде | Мало растворим, ок. 0,17 г/100 мл при комнатной температуре. |
| Растворимость | Нерастворим в спирте и эфире. |
| Давление газа | Непригодный |
| Плотность пара | Непригодный |
| пКа | 1,91 |
| рН | Слегка щелочной (pH 8-9 при растворении в воде) |
Безопасность и опасность сульфита кальция
CaSO3 обычно считается безопасным для использования в пищевой промышленности и очистке воды. Однако, как и любое химическое вещество, оно может представлять определенную опасность при неправильном обращении. CaSO3 раздражает кожу и глаза и может вызвать раздражение дыхательных путей при вдыхании. Проглатывание большого количества CaSO3 может вызвать тошноту, рвоту и диарею. При работе с CaSO3 следует соблюдать соответствующие меры предосторожности, например, надевать перчатки и защитные очки. Следует немедленно обратиться за медицинской помощью при попадании CaSO3 на кожу, в глаза или при проглатывании. Также важно соблюдать надлежащие процедуры хранения и утилизации CaSO3, чтобы свести к минимуму потенциальные опасности.
| Символы опасности | Ничего не назначено |
| Описание безопасности | Избегайте контакта с глазами, кожей и одеждой. При работе надевайте защитные перчатки и очки. В случае попадания промыть пораженные участки водой. При проглатывании немедленно обратитесь за медицинской помощью. |
| Идентификационные номера ООН | Непригодный |
| код ТН ВЭД | 283210 |
| Класс опасности | Не классифицируется как опасный |
| Группа упаковки | Непригодный |
| Токсичность | Сульфит кальция считается нетоксичным в низких концентрациях, но в высоких дозах может вызывать раздражение желудочно-кишечного тракта и другие последствия для здоровья. |
Методы синтеза сульфита кальция
Реакция сернистой кислоты с гидроксидом кальция позволяет синтезировать CaSO3. В результате реакции в качестве побочных продуктов образуются CaSO3 и вода.
Другой метод включает реакцию карбоната кальция с сернистой кислотой, в результате которой образуются CaSO3, вода и углекислый газ. Обычно химики проводят реакцию в водном растворе при комнатной температуре или немного выше.
В другом методе при взаимодействии оксида кальция с диоксидом серы и последующем добавлении воды к полученному продукту образуется CaSO3.
В промышленных условиях абсорбция диоксида серы суспензией гидроксида кальция обычно приводит к образованию CaSO3. В результате этого процесса образуется смесь CaSO3 и сульфата кальция, которую можно разделить фильтрацией или другими методами. Полученный CaSO3 можно использовать в различных целях, включая очистку воды и в качестве консерванта пищевых продуктов.
В целом существует несколько методов синтеза CaSO3, каждый из которых имеет свои преимущества и ограничения в зависимости от конкретного применения и желаемой чистоты конечного продукта.
Использование сульфита кальция
CaSO3 имеет различное применение в различных отраслях промышленности благодаря своим уникальным свойствам. Некоторые распространенные применения CaSO3 включают:
- Очистка воды: часто используется в качестве средства очистки воды для удаления примесей и дезинфекции воды. Он может эффективно удалять хлор, тяжелые металлы и другие загрязнения из воды.
- Консервация пищевых продуктов: используется в качестве консерванта для предотвращения порчи и продления срока годности пищевых продуктов. Обычно используется при производстве консервированных и бутилированных пищевых продуктов, а также при производстве вина и пива.
- Химическая промышленность: Используется в химической промышленности в качестве восстановителя и при производстве серной кислоты.
- Строительство: Используется в качестве компонента строительных материалов, таких как гипсокартон и цемент.
- Сельскохозяйственная промышленность: Используется в сельском хозяйстве для обработки почвы и предотвращения болезней растений.
- Медицинское применение: Также используется в медицине в качестве антиоксиданта и для лечения определенных заболеваний.
Вопросы:
Вопрос: Какова формула сульфита кальция?
Ответ: Формула сульфита кальция: CaSO3.
Вопрос: Каково состояние сульфита кальция?
Ответ: CaSO3 является твердым веществом при комнатной температуре.
Вопрос: Сколько граммов кальция содержится в 3,36 граммах CaSO3?
Ответ: В 3,36 граммах CaSO3 содержится примерно 1,14 грамма кальция.
Вопрос: Что произойдет, если добавить карбонат кальция к соляной кислоте и сульфиту натрия?
Ответ: Когда карбонат кальция добавляется к соляной кислоте и сульфиту натрия, происходит реакция, в результате которой образуется CaSO3, вода, углекислый газ и хлорид натрия.
Вопрос: Растворяется ли сульфит кальция в воде?
О: Да, CaSO3 слабо растворим в воде.
Вопрос: Есть ли в городской воде сульфит кальция?
Ответ: CaSO3 обычно не встречается в городской воде, но его можно использовать в процессах очистки воды для удаления примесей.
Вопрос: Можно ли удалить CaSO3 из питьевой воды?
Ответ: Да, CaSO3 можно удалить из питьевой воды различными методами, такими как фильтрация, обратный осмос или химическая обработка.
Вопрос: Что производят CaSO3 и HCl?
Ответ: Когда CaSO3 добавляется к соляной кислоте, происходит реакция, в результате которой образуется хлорид кальция, газообразный диоксид серы и вода.
