Сульфит натрия, также известный как Na2SO3, представляет собой белый кристаллический порошок, обычно используемый в качестве консерванта в пищевой промышленности и в качестве восстановителя в фотографии.
| Название ИЮПАК | Сульфит динатрия |
| Молекулярная формула | Na2SO3 |
| Количество CAS | 7757-83-7 |
| Синонимы | Сульфит натрия; сульфит натрия; Сернистая кислота, динатриевая соль; Сульфонат натрия; Сульфит натрия |
| ИнЧИ | InChI=1S/2Na.H2O3S/c;;1-4(2)3/h;;(H2,1,2,3)/q2*+1;/p-2 |
Свойства сульфита натрия
Формула сульфита натрия
Химическая формула сульфита натрия: Na2SO3. Он состоит из двух ионов Na+ и одного иона SO32-. Ионы Na+ несут положительный заряд, а ион SO32- — отрицательный. Сульфит натрия представляет собой ионное соединение, образующее белый кристаллический порошок.
сульфит натрия Молярная масса
Молярная масса Na2SO3 составляет 126,04 г/моль. Это значение получается путем сложения атомных масс каждого элемента в соединении. Атомные массы натрия, серы и кислорода составляют 22,99 г/моль, 32,06 г/моль и 15,99 г/моль соответственно. Молярная масса является важным параметром, используемым в стехиометрических расчетах, а также может использоваться для определения количества вещества, присутствующего в образце.
Температура кипения сульфита натрия
Na2SO3 имеет относительно высокую температуру кипения — 1650°C. Это связано с прочными ионными связями между ионами Na+ и SO32-, для разрыва которых требуется большое количество энергии. Точка кипения – это температура, при которой вещество переходит из жидкой фазы в газовую. При этой температуре давление пара жидкости равно атмосферному давлению.
Температура плавления сульфита натрия
Температура плавления Na2SO3 составляет 33,4°С. Такая относительно низкая температура плавления обусловлена слабыми межмолекулярными силами между молекулами Na2SO3. При нагревании межмолекулярные силы преодолеваются и твердый Na2SO3 плавится в жидкость.
Плотность сульфита натрия г/мл
Плотность Na2SO3 составляет 2,633 г/мл. Плотность определяется как масса вещества в единице объема. Высокая плотность Na2SO3 обусловлена его ионной природой и наличием в его структуре двух ионов натрия на один сульфитный ион.
Молекулярный вес сульфита натрия
Молекулярная масса Na2SO3 составляет 126,04 г/моль. Это значение получается путем сложения атомных весов каждого элемента в соединении. Молекулярная масса является важным параметром, используемым в стехиометрических расчетах, а также может использоваться для определения количества вещества, присутствующего в образце.
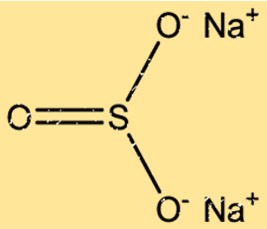
Структура сульфита натрия
Na2SO3 имеет кристаллическую структуру с двумя ионами Na+ и одним ионом SO32-, расположенными повторяющимся узором. Ионы Na+ расположены в гранецентрированной кубической решетке, а ионы SO32- занимают октаэдрические узлы решетки. Ионные связи между ионами Na+ и SO32- приводят к стабильной кристаллической структуре.
Растворимость сульфита натрия
Na2SO3 хорошо растворим в воде, его растворимость составляет 22,4 г/100 мл при 20°C. Такая высокая растворимость обусловлена ионной природой Na2SO3, которая позволяет ему диссоциировать в воде с образованием ионов Na+ и SO32-. Растворимость Na2SO3 в воде увеличивается с температурой, так как кинетическая энергия молекул увеличивается и в раствор выделяется больше ионов.
| Появление | Белый кристаллический порошок |
| Удельный вес | 2,633 г/см³ |
| Цвет | От бесцветного до белого |
| Запах | Без запаха |
| Молярная масса | 126,04 г/моль |
| Плотность | 2633 г/мл |
| Точка плавления | 33,4°С |
| Точка кипения | 1650°С |
| Мигающая точка | Непригодный |
| Растворимость в воде | Очень растворим |
| Растворимость | Растворим в глицерине, слабо растворим в этаноле. |
| Давление газа | 0 мм рт.ст. при 20°C |
| Плотность пара | Непригодный |
| пКа | 6:35 утра. |
| рН | 8,3 – 9,5 (5% раствор) |
Безопасность и опасность сульфита натрия
Na2SO3 может быть опасен при неправильном обращении. Он может вызвать раздражение кожи и глаз, а при проглатывании может вызвать тошноту, рвоту и боль в животе. При вдыхании он также может вызвать раздражение дыхательных путей. Кроме того, Na2SO3 может вступать в реакцию с другими химическими веществами с образованием токсичных газов, таких как диоксид серы, которые могут быть вредны для вашего здоровья. Поэтому важно носить соответствующие средства индивидуальной защиты при работе с Na2SO3 и избегать попадания в глаза, кожу и слизистые оболочки. Na2SO3 также следует хранить в прохладном, сухом, хорошо проветриваемом помещении вдали от несовместимых материалов.
| Символы опасности | Си, О |
| Описание безопасности | Избегайте контакта с кожей и глазами. В случае попадания немедленно промыть большим количеством воды и обратиться к врачу. Не глотать. Избегайте вдыхания пыли. Носите соответствующие средства индивидуальной защиты. Беречь от тепла, искр и пламени. |
| ИН ID | 1384 |
| код ТН ВЭД | 283210 |
| Класс опасности | 8 – Коррозионные вещества |
| Группа упаковки | III |
| Токсичность | ЛД50 (перорально, крыса) – 1640 мг/кг; LC50 (ингаляционно, крыса) – 63 мг/м³ |
Методы синтеза сульфита натрия
Различные методы позволяют синтезировать Na2SO3.
Распространенным методом является реакция гидроксида натрия с сернистым газом в присутствии воды. В результате реакции в качестве побочных продуктов образуются Na2SO3 и вода.
В другом методе карбонат натрия реагирует с сернистым газом в присутствии воды, образуя Na2SO3 и углекислый газ. Для увеличения выхода Na2SO3 эту реакцию можно проводить при высоких температурах и давлениях.
Реакция бисульфита натрия с гидроксидом натрия позволяет синтезировать Na2SO3. В результате этой реакции в качестве побочных продуктов образуются Na2SO3, вода и хлорид натрия.
Другой метод включает реакцию сульфида натрия с сернистым газом в присутствии воды с образованием Na2SO3 и сероводорода.
Для синтеза Na2SO3 сульфат натрия необходимо обработать сернистым газом в присутствии восстановителя, например активированного угля. В результате этой реакции образуются Na2SO3 и углекислый газ.
Каждый из этих методов имеет свои преимущества и недостатки, а выбор метода зависит от различных факторов, таких как желаемый выход, чистота и стоимость продукта, наличие реагентов и оборудования.
Применение сульфита натрия
Na2SO3 имеет несколько важных промышленных и коммерческих применений, в том числе:
- Фотография: используется в качестве восстановителя и консерванта в средствах для проявки фотографий. Это помогает стабилизировать изображение и предотвратить выцветание.
- Очистка воды: используется для удаления хлора и избыточного кислорода из воды на промышленных и муниципальных водоочистных станциях. Это также помогает предотвратить коррозию труб и оборудования.
- Бумажно-целлюлозная промышленность: используется при производстве бумаги и целлюлозы для отбеливания и снижения содержания лигнина в целлюлозе. Это помогает улучшить качество и цвет бумаги.
- Пищевая промышленность: используется в качестве консерванта и антиоксиданта в пищевой промышленности. Это помогает предотвратить изменение цвета и порчу пищевых продуктов, таких как сухофрукты, вино и пиво.
- Текстильная промышленность: используется в качестве восстановителя и отбеливателя в текстильной промышленности для удаления излишков красителя и улучшения стойкости цвета тканей.
- Химическая промышленность: используется в качестве восстановителя в различных химических реакциях, например, при производстве красителей, фармацевтических препаратов и полимеров.
- Другое использование: Также используется в производстве моющих средств, изделий из кожи и средств личной гигиены, таких как краски для волос и шампуни.
Вопросы:
Вопрос: Что такое обычный сульфит натрия в котле?
Ответ: Нормальная концентрация Na2SO3 в котле обычно составляет от 20 до 40 частей на миллион (ppm), в зависимости от рабочего давления и других факторов.
Вопрос: Как сбалансировать диоксид серы с гидроксидом натрия, чтобы образовался сульфит натрия и вода?
Ответ: Чтобы сбалансировать уравнение реакции диоксида серы и гидроксида натрия с образованием Na2SO3 и воды, необходимо обеспечить, чтобы в двух частях уравнения было одинаковое количество атомов каждого элемента. Сбалансированное уравнение будет выглядеть так: SO2 + 2NaOH → Na2SO3 + H2O.
Вопрос: Что такое сульфит натрия?
Ответ: Na2SO3 представляет собой белое кристаллическое соединение, обычно используемое в различных промышленных и коммерческих целях, таких как фотография, очистка воды, производство бумаги и консервирование пищевых продуктов.
Вопрос: Какова формула сульфита натрия?
Ответ: Формула сульфита натрия: Na2SO3.
Вопрос: Основан ли на сульфите натрия?
Ответ: Na2SO3 представляет собой соль сильного основания (гидроксида натрия) и слабой кислоты (сернистой кислоты) и поэтому обладает основными свойствами. Однако обычно это не считается прочным фундаментом.
Вопрос: Стабилен ли сульфит натрия в воде?
Ответ: Na2SO3 относительно стабилен в воде, но со временем может постепенно разлагаться, особенно в присутствии кислорода или других окислителей.
Вопрос: Является ли сульфит натрия легковоспламеняющимся?
Ответ: Na2SO3 негорюч, но может вступать в реакцию с некоторыми окислителями с выделением диоксида серы, который раздражает дыхательные пути и может быть легковоспламеняющимся.
Вопрос: Где купить сульфит натрия на месте?
О: Na2SO3 можно приобрести у компаний-поставщиков химической продукции, промышленных поставщиков и некоторых специализированных розничных торговцев. Его также можно приобрести в некоторых местных хозяйственных магазинах или центрах благоустройства дома.
Вопрос: Какие продукты содержат сульфит натрия?
Ответ: Na2SO3 обычно используется в качестве консерванта в таких продуктах, как вино, пиво, сухофрукты и некоторые обработанные мясные продукты.
Вопрос: Какой продукт равен сульфиту натрия?
Ответ: Бисульфит натрия — аналогичное соединение, которое в некоторых случаях можно использовать вместо Na2SO3. Другие заменители могут включать метабисульфит натрия или метабисульфит калия.
