Нитрит калия (KNO2) — химическое соединение, обычно используемое в качестве пищевого консерванта. Известно, что он подавляет рост бактерий и предотвращает порчу мяса и других продуктов.
| Название ИЮПАК | Нитрит калия |
| Молекулярная формула | КНО2 |
| Количество CAS | 7758-09-0 |
| Синонимы | Азотистая кислота, калийная соль; селитра(III); азотистая кислота, соединение. с калиевой солью (1:1); Е249 |
| ИнЧИ | ИнХI=1S/K.NO2/c;2-1-3/q+1;-1 |
Свойства нитрита калия
Формула нитрита калия
Химическая формула нитрита калия — KNO2. Он представляет собой состав соединения с точки зрения составляющих его атомов. Формула нитрита калия используется для расчета его молярной массы и молекулярной массы.
Нитрит калия Молярная масса
Молярная масса KNO2 составляет 85,103 г/моль. Он получается из суммы атомных масс калия (39,10 г/моль), азота (14,01 г/моль) и двух атомов кислорода (2 х 16,00 г/моль). Молярная масса KNO2 важна для определения количества вещества в данной массе или объеме.
Температура кипения нитрита калия
Температура кипения KNO2 составляет 320°C (608°F). При этой температуре соединение переходит из жидкой фазы в газовую. Температура кипения KNO2 зависит от различных факторов, таких как давление и чистота.
Температура плавления нитрита калия
Температура плавления KNO2 составляет 441°C (826°F). При этой температуре твердое соединение переходит в жидкую фазу. Температура плавления KNO2 является решающим параметром, определяющим его пригодность для различных применений, таких как консервирование пищевых продуктов и медицина.
Плотность нитрита калия г/мл
Плотность KNO2 составляет 1,915 г/мл при комнатной температуре. Плотность вещества определяется как масса вещества в единице объема. Плотность KNO2 играет важную роль в определении его физических свойств, таких как растворимость и химическая реакционная способность.
Нитрит калия Молекулярный вес
Молекулярная масса KNO2 составляет 85,103 г/моль. Это важнейший параметр для определения стехиометрии реакции с участием KNO2. Молекулярная масса KNO2 также используется для определения его физических и химических свойств.
Структура нитрита калия
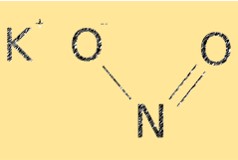
KNO2 имеет молекулярную формулу KNO2. Он имеет ионную структуру с катионами калия (K+) и нитрит-анионами (NO2-). Нитрит-ион имеет изогнутую молекулярную геометрию с валентным углом примерно 115 °. Структура KNO2 важна для определения его химических свойств, таких как растворимость и реакционная способность.
Растворимость нитрита калия
KNO2 хорошо растворим в воде, его растворимость составляет около 710 г/л при 20°C. Растворимость KNO2 зависит от различных факторов, таких как температура, давление и присутствие других веществ. Растворимость KNO2 является решающим параметром при определении его пригодности для различных применений, таких как консервирование пищевых продуктов и медицина.
| Появление | Кристаллическое твердое вещество от белого до желтоватого цвета |
| Удельный вес | 1915 |
| Цвет | От бесцветного до белого |
| Запах | Без запаха |
| Молярная масса | 85,103 г/моль |
| Плотность | 1,915 г/мл |
| Точка плавления | 441°С (826°Ф) |
| Точка кипения | 320°С (608°Ф) |
| Мигающая точка | Непригодный |
| Растворимость в воде | Очень растворим (710 г/л при 20°C) |
| Растворимость | Растворим в этаноле, слабо растворим в аммиаке. |
| Давление газа | 0,0038 мм рт.ст. при 25°C |
| Плотность пара | 2,96 (воздух = 1) |
| пКа | 3.35 |
| рН | 5-8 (5% раствор) |
Нитрит калия: безопасность и опасности
KNO2 может быть опасен при неправильном обращении. Он вреден при проглатывании или вдыхании и может вызвать раздражение глаз, кожи и дыхательных путей. Длительное или неоднократное воздействие KNO2 может вызвать метгемоглобинемию — состояние, при котором снижается способность крови переносить кислород. KNO2 также является сильным окислителем и может бурно реагировать с горючими материалами, вызывая пожар или взрыв. При обращении с KNO2 следует соблюдать надлежащие меры безопасности, такие как использование защитного оборудования, адекватная вентиляция и безопасное хранение. При проглатывании или вдыхании немедленно обратитесь за медицинской помощью.
| Символы опасности | Хн |
| Описание безопасности | С22, С24/25 |
| Идентификационные номера ООН | ООН 1488 |
| код ТН ВЭД | 2834.29.10 |
| Класс опасности | 5.1 |
| Группа упаковки | III |
| Токсичность | Вреден при проглатывании или вдыхании, может вызвать метгемоглобинемию. |
Методы синтеза нитрита калия
Гидроксид калия (KOH) реагирует с азотистой кислотой (HNO2) с образованием KNO2. В результате реакции образуются KNO2 и вода (H2O) в качестве побочных продуктов. Промышленность обычно использует этот метод для производства больших количеств KNO2.
Уравнение реакции:
2 КОН + HNO2 → KNO2 + 2 H2O
Другой метод синтеза KNO2 — взаимодействие карбоната калия (K2CO3) с оксидом азота (NO). В результате реакции в качестве побочных продуктов образуются KNO2, диоксид углерода (CO2) и азот (N2). Получение оксида азота сложно и дорого, поэтому этот метод используется реже.
Уравнение реакции:
2 K2CO3 + 2 NO → 2 KNO2 + 2 CO2 + N2
KNO2 можно получить окислением KNO3 с помощью восстановителя, такого как SO2 или FeSO4.
В результате реакции в качестве побочных продуктов образуются KNO2, вода и восстановленная форма восстановителя. Ученые используют этот метод реже и обычно оставляют его для небольших лабораторных синтезов.
Уравнение реакции с диоксидом серы:
2 KNO3 + 3 SO2 + H2O → 2 KNO2 + 3 H2SO4
Использование нитрита калия
KNO2 имеет несколько промышленных и лабораторных применений благодаря своим химическим свойствам. Некоторые из распространенных применений KNO2:
- Консервация пищевых продуктов: используется в качестве консерванта в колбасных изделиях для предотвращения роста вредных бактерий и продления срока их хранения.
- Химическая промышленность: используется в качестве промежуточного продукта в производстве ряда химических веществ, таких как азотистая кислота, соединения диазония и органические нитриты.
- Сельское хозяйство: используется в качестве удобрения и кондиционера почвы из-за его высокой растворимости в воде и способности выделять азот.
- Лабораторный реагент: используется в качестве реагента в нескольких лабораторных приложениях, таких как обнаружение первичных аминов и получение солей диазония.
- Лекарственное применение: используется при лечении отравления цианидами, поскольку вступает в реакцию с ионами цианида с образованием нетоксичного цианметгемоглобина.
- Фотография: используется в качестве добавки в фотопроявителях для улучшения качества и четкости проявленных изображений.
- Стекольная промышленность: используется в стекольной промышленности в качестве отбеливателя для удаления нежелательной окраски стеклянных изделий.
Вопросы:
Что такое нитрит калия?
Ответ: KNO2 — это неорганическое соединение, обычно используемое в различных промышленных и лабораторных приложениях.
Вопрос: Какова формула нитрита калия?
Ответ: Химическая формула нитрита калия — KNO2.
Вопрос: Какая соль образуется при реакции NH4OH с HNO3? KNO2, NaNO3, NH4NO3 или NH4NO2?
Ответ: Когда NH4OH реагирует с HNO3, образуется соль NH4NO3.
Вопрос: KNO2 – это кислота или основание?
Ответ: KNO2 является основным соединением.
Вопрос: Как называется соединение с формулой KNO2?
Ответ: Название соединения с формулой KNO2 – нитрит калия.
Вопрос: Является ли KNO2 слабым основанием?
Ответ: KNO2 считается слабым основанием.
Вопрос: KNO2 является кислым или основным?
Ответ: KNO2 является основным по своей природе и может действовать как мягкий восстановитель.
