Нитрит кальция (Ca(NO2)2) представляет собой химическое соединение, обычно используемое в качестве ингибитора коррозии бетона. Это помогает предотвратить коррозию стальной арматуры.
| Название ИЮПАК | Динитрит кальция |
| Молекулярная формула | Са(NO2)2 |
| Количество CAS | 13780-06-8 |
| Синонимы | Дигидрат нитрита кальция, азотистая кислота, соль кальция, азотная кислота, соль кальция, дигидрат и т. д. |
| ИнЧИ | InChI=1S/Ca.2HNO2/c;2 2-1-3/ч;2 (H,2,3) |
Свойства нитрита кальция
Формула нитрита кальция
Химическая формула нитрита кальция: Ca(NO2)2. Эта формула указывает на то, что соединение содержит два нитрит-аниона на каждый катион кальция. Формула важна для определения состава соединения и количества каждого элемента в соединении.
Нитрит кальция Молярная масса
Молярная масса Ca(NO2)2, также известного как динитрит кальция, составляет примерно 132,09 г/моль. Это ионное соединение, состоящее из катионов кальция и нитрит-анионов. Молярную массу рассчитывают путем сложения атомных масс составляющих элементов соединения, которыми в данном случае являются кальций, азот и кислород.
Температура кипения нитрита кальция
Ca(NO2)2 имеет высокую температуру кипения около 400°C (752°F). Такая высокая температура кипения обусловлена прочными ионными связями, существующими между ионами Ca2+ и NO2- в соединении. При нагревании Ca(NO2)2 он подвергается термическому разложению с выделением диоксида азота и кислорода.
Нитрит кальция Температура плавления
Ca(NO2)2 имеет температуру плавления примерно 132°C (270°F). Эта точка плавления относительно низкая по сравнению с другими ионными соединениями, такими как хлорид натрия, температура плавления которого составляет 801°C (1474°F). Низкая температура плавления Ca(NO2)2 может быть объяснена относительно слабыми ионными связями, существующими между ионами Ca2+ и NO2-.
Плотность нитрита кальция г/мл
Плотность Ca(NO2)2 составляет примерно 2,32 г/мл. Это значение указывает на то, что Ca(NO2)2 является относительно плотным соединением. Плотность рассчитывается путем деления массы соединения на его объем. Высокую плотность Ca(NO2)2 можно объяснить наличием относительно тяжелых катионов кальция.
Нитрит кальция Молекулярный вес
Молекулярная масса Ca(NO2)2 составляет примерно 132,09 г/моль. Это значение рассчитывается путем сложения атомных масс составляющих элементов соединения. Молекулярная масса важна при определении количества Ca(NO2)2, необходимого для получения определенного количества молей соединения.
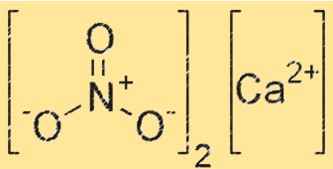
Структура нитрита кальция
Структура Ca(NO2)2 состоит из Ca2+ и NO2-. Ионы Ca2+ расположены в центре кристаллической решетки, а ионы NO2- окружают их. Кристаллическая решетка удерживается прочными ионными связями между ионами Ca2+ и NO2-.
Растворимость нитрита кальция
Ca(NO2)2 растворим в воде и спирте. Растворимость в воде относительно высокая: растворимость составляет примерно 61 г/100 мл воды при комнатной температуре. Растворимость в спирте ниже, чем в воде. Растворимость Ca(NO2)2 важна при определении его использования в различных целях, например, при производстве бетона.
| Появление | Кристаллический порошок или твердое вещество от белого до слегка желтого цвета. |
| Удельный вес | 2.32 |
| Цвет | От бесцветного до белого |
| Запах | Без запаха |
| Молярная масса | 132,09 г/моль |
| Плотность | 2,32 г/мл |
| Точка плавления | 132°С (270°Ф) |
| Точка кипения | Разлагается при температуре примерно 400°C (752°F). |
| Мигающая точка | Непригодный |
| Растворимость в воде | Растворимый |
| Растворимость | Растворим в воде и спирте |
| Давление газа | Непригодный |
| Плотность пара | Непригодный |
| пКа | Непригодный |
| рН | Нейтральный |
Безопасность и опасность нитрита кальция
Ca(NO2)2 может быть вредным при проглатывании, вдыхании или попадании на кожу или в глаза. Это может вызвать раздражение, ожоги и проблемы с дыханием. Соединение также является окислителем и может вступать в реакцию с другими химическими веществами, такими как кислоты и металлы, с образованием опасных веществ. Ca(NO2)2 следует хранить в прохладном, сухом, хорошо вентилируемом помещении вдали от несовместимых материалов. При работе с составом следует использовать средства индивидуальной защиты, такие как перчатки и очки. В случае воздействия следует немедленно обратиться за медицинской помощью и снять загрязненную одежду.
| Символы опасности | Хн |
| Описание безопасности | Избегайте контакта с кожей и глазами; носить средства индивидуальной защиты (СИЗ); В случае воздействия немедленно обратитесь за медицинской помощью. |
| Идентификационные номера ООН | ООН 1454 |
| код ТН ВЭД | 2834.29.90 |
| Класс опасности | 5.1 |
| Группа упаковки | III |
| Токсичность | Вреден при проглатывании или вдыхании; может вызвать раздражение, ожоги и проблемы с дыханием |
Методы синтеза нитрита кальция
Синтезировать Ca(NO2)2 можно различными методами, включая реакцию азотной кислоты или оксидов азота с карбонатом кальция , реакцию азотистой кислоты или оксидов азота с гидроксидом углерода. кальция и реакция гидроксида кальция или гидроксида аммония с нитратом кальция.
Распространенным методом является реакция карбоната кальция с азотной кислотой с получением нитрата кальция. Далее реакция нитрата кальция с гидроксидом кальция приводит к образованию Ca(NO2)2 и побочных продуктов оксида кальция.
Другой метод включает реакцию оксидов азота с гидроксидом кальция с образованием Ca(NO2)2 и нитрата кальция.
В другом методе можно провести реакцию нитрата кальция с гидроксидом кальция или гидроксидом аммония с образованием Ca(NO2)2 с образованием нитрата кальция в качестве побочного продукта.
Использование нитрита кальция
Ca(NO2)2 имеет различные применения в различных отраслях промышленности, в том числе:
- Бетонная промышленность: используется в качестве добавки к бетону для увеличения долговечности и прочности бетонных конструкций. Он действует как ингибитор коррозии, защищая арматурную сталь от коррозии, вызванной хлоридами и другими агрессивными ионами.
- Сельское хозяйство: используется в качестве удобрения в сельском хозяйстве для обеспечения растений источником азота и кальция. Также используется в качестве удобрения для улучшения качества почвы и стимулирования роста растений.
- Химическая промышленность: используется в качестве восстановителя в химических реакциях, а также в качестве прекурсора для синтеза других химических веществ, таких как нитрат кальция и нитрат кальция-аммония.
- Очистка сточных вод: используется в качестве химиката для очистки сточных вод для удаления загрязнений и снижения концентрации вредных веществ в воде.
- Пищевая промышленность: используется в качестве пищевого консерванта для предотвращения роста бактерий и других микроорганизмов в мясе, рыбе и других пищевых продуктах.
Вопросы:
Вопрос: Какова формула нитрита кальция?
Ответ: Химическая формула нитрита кальция: Ca(NO2)2.
Вопрос: Сколько нитрита кальция используется в бетоне каждый год?
Ответ: Количество Ca(NO2)2, используемое в бетоне каждый год, варьируется в зависимости от конкретного применения и рыночного спроса. Однако, по оценкам, каждый год во всем мире в качестве добавки к бетону используется несколько тысяч тонн Ca(NO2)2.
Вопрос: Растворим ли нитрит кальция в воде?
Ответ: Да, Ca(NO2)2 растворим в воде. Его растворимость составляет примерно 167 г/л при 20°C.
Вопрос: Является ли нитрит кальция солью?
Ответ: Да, Ca(NO2)2 — это соль. Ионное соединение, состоящее из катионов кальция (Ca2+) и нитрит-анионов (NO2-).
Вопрос: Как будут готовиться следующие растворы? 1,25 л 0,775 М раствора Ca(NO2)2
A: Чтобы приготовить 1,25 л 0,775 М раствора Ca(NO2)2, вам необходимо растворить примерно 187,5 г Ca(NO2)2 в достаточном количестве воды, чтобы получить конечный объем 1,25 л. Это можно рассчитать с помощью Формула формулы: граммы растворенного вещества = молярность х объем (в литрах) х молярная масса растворенного вещества.
Вопрос: Какова формула ионного соединения нитрита кальция?
A: Формула ионного соединения Ca(NO2)2: Ca(NO2)2. Он состоит из одного иона кальция (Ca2+) и двух ионов нитрита (NO2-).
