Бром (Br2) представляет собой двухатомную молекулу, состоящую из двух атомов брома. Это красновато-коричневая жидкость при комнатной температуре, очень реакционноспособная. Он используется в различных отраслях промышленности, включая фармацевтику, сельское хозяйство и очистку воды.
| Название ИЮПАК | Бром |
| Молекулярная формула | Бр2 |
| Количество CAS | 7726-95-6 |
| Синонимы | Бром, Молекулярный бром, ООН 1744, Двухатомный бром, Бром-79, Бром-81 |
| ИнЧИ | ИнЧИ=1С/Бр2/с1-2 |
Свойства брома
Формула брома
Химическая формула брома – Br2. Это означает, что молекула брома содержит два атома брома. Формула используется для представления состава вещества и имеет важное значение в химических реакциях. Формула брома используется в различных отраслях промышленности, включая фармацевтику, водоочистку и сельское хозяйство.
бром Молярная масса
Молярная масса Br2 составляет 159,808 г/моль. Это масса одного моля молекул Br2. Молярная масса является важным свойством в химии, поскольку помогает определить количество вещества, необходимое для данной реакции. Он также используется для преобразования граммов и молей вещества.
Температура кипения брома
Br2 имеет температуру кипения 58,8°C (137,8°F). Это температура, при которой Br2 переходит из жидкого состояния в газообразное. Низкая температура кипения Br2 обусловлена его слабыми межмолекулярными силами, которые позволяют молекулам легче выходить из жидкого состояния. Высокая реакционная способность Br2 делает его опасным при обращении с ним при высоких температурах.
Температура плавления брома
Температура плавления Br2 составляет -7,2°C (19,0°F). Это температура, при которой твердый Br2 переходит в жидкое состояние. Низкая температура плавления Br2 обусловлена его слабыми межмолекулярными силами, которые позволяют молекулам легче перемещаться в твердом состоянии. Br2 обладает уникальным свойством существовать в жидком виде при комнатной температуре, что редко встречается среди галогенов.
Плотность брома г/мл
Плотность Br2 составляет 3,12 г/мл. Это значит, что один миллилитр Бр2 имеет массу 3,12 грамма. Высокая плотность Br2 обусловлена его молекулярной массой и герметичностью его молекул в жидком состоянии. Высокая плотность Br2 делает его полезным в реакциях тяжелого органического синтеза.
Молекулярный вес брома
Молекулярная масса Br2 составляет 79,90 г/моль. Это сумма атомных весов двух атомов Br в молекуле Br2. Молекулярный вес является важным свойством в химии, поскольку он помогает определить количество вещества, необходимое для данной реакции.
Структура брома
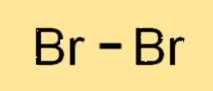
Br2 представляет собой двухатомную молекулу, то есть она состоит из двух атомов Br, связанных вместе. Два атома Br2 имеют общую пару электронов, образующих ковалентную связь. Молекула Br2 имеет линейную структуру: два атома Br расположены в одну линию. Структура Br2 аналогична структуре других галогенов, таких как хлор и йод.
| Появление | Красновато-коричневая жидкость |
| Удельный вес | 3,12 г/мл |
| Цвет | красновато-коричневый |
| Запах | Резкий и раздражающий запах |
| Молярная масса | 159 808 г/моль |
| Плотность | 3,12 г/мл |
| Точка плавления | -7,2°С (19,0°Ф) |
| Точка кипения | 58,8°С (137,8°Ф) |
| Мигающая точка | Не воспламеняется |
| Растворимость в воде | 3,41 г/100 мл (25°С) |
| Растворимость | Растворим в хлороформе, четыреххлористом углероде и эфире. |
| Давление газа | 1,13 кПа при 25°C |
| Плотность пара | 5,4 г/л |
| пКа | -5 |
| рН | Непригодный |
Безопасность и опасность брома
Br2 является опасным химическим веществом, и с ним следует обращаться осторожно. Это едкая жидкость, которая может вызвать серьезное раздражение кожи и глаз. Вдыхание паров Br2 может вызвать проблемы с дыханием, а воздействие высоких концентраций может привести к летальному исходу. Br2 также является сильным окислителем и может бурно реагировать с легковоспламеняющимися материалами, вызывая пожары или взрывы. При работе с Br2 всегда следует носить соответствующие защитные средства, такие как перчатки, очки и респираторы. Его следует хранить в прохладном, сухом, хорошо проветриваемом помещении, вдали от источников тепла и несовместимых материалов. В случае разлива или аварии немедленно покиньте помещение и выполните надлежащие процедуры очистки.
| Символы опасности | Череп и скрещенные кости, Едкие |
| Описание безопасности | Очень токсичен, разъедает и раздражает кожу, глаза и дыхательную систему. |
| Идентификационные номера ООН | ООН1744 |
| код ТН ВЭД | 2801.30 |
| Класс опасности | 8 |
| Группа упаковки | II |
| Токсичность | LD50 (перорально, крыса) = 2–3 мг/кг. |
Методы синтеза брома
Для синтеза Br2 можно использовать разные методы в зависимости от желаемой чистоты и количества.
Один метод включает обработку рассола газообразным хлором в присутствии катализатора, такого как железо. Полученный раствор гипохлорита натрия и хлорида натрия затем подкисляют соляной кислотой, выделяя газ Br2.
Другой метод включает окисление газообразного бромистого водорода газообразным кислородом в присутствии катализатора, такого как платина или асбест. Промышленность обычно использует этот метод для производства Br2 высокой чистоты для своих нужд.
Электролиз извлекает Br2 из рассола путем пропускания через раствор электрического тока, который разделяет ионы натрия и хлорида и производит газ Br2 в качестве побочного продукта.
Использование брома
Br2 имеет несколько важных применений в различных отраслях промышленности, в том числе:
- Производители используют соединения на основе брома в качестве антипиренов в текстиле, пластмассах и электронном оборудовании, чтобы снизить риск возгорания за счет предотвращения распространения огня.
- Фармацевтические компании используют соединения брома при производстве различных седативных средств, транквилизаторов и анальгетиков.
- На водоочистных станциях соединения на основе брома используются в качестве дезинфицирующего средства для эффективного уничтожения бактерий, вирусов и других вредных организмов.
- Производители пестицидов и гербицидов используют соединения на основе брома для эффективной борьбы с вредителями и сорняками.
- Нефтяная и газовая промышленность использует соединения на основе брома в буровых операциях для борьбы с коррозией и повышения нефтеотдачи.
- Производители используют соединения на основе брома при производстве фотопленок и бумаги для эффективного контроля чувствительности и контрастности изображений.
- В реакциях химического синтеза Br2 используется в качестве реагента для производства красителей, пластмасс и фармацевтических препаратов.
Вопросы:
Вопрос: Br2 полярный или неполярный?
Ответ: Br2 является неполярной молекулой, поскольку оба атома брома имеют одинаковую электроотрицательность, что приводит к равному распределению электронов в ковалентной связи.
Вопрос: Какое соединение, скорее всего, содержит полярные ковалентные связи? NaCl, AlF3, Br2, NF3?
Ответ: Соединением, которое, скорее всего, содержит полярные ковалентные связи, является NF3 (трифторид азота), поскольку атомы азота и фтора имеют очень разную электроотрицательность, что приводит к неравному распределению электронов в ковалентной связи.
Вопрос: Какова ΔH0 для этой реакции? Br2 (г) → Br2 (ж), ΔHf° Br2 (г) = 30,91 кДж/моль
Ответ: ΔH0 для реакции составляет -10,57 кДж/моль, поскольку теплота испарения Br2 составляет 41,48 кДж/моль, а теплота плавления 30,91 кДж/моль (приведена в вопросе).
Вопрос: Br2 — это газ?
Ответ: Br2 может существовать в газообразном и жидком состояниях в зависимости от условий температуры и давления. При комнатной температуре и стандартном давлении Br2 представляет собой жидкость красновато-коричневого цвета.
Вопрос: Для чего используется бром?
Ответ: Бром имеет несколько важных применений в различных отраслях промышленности, включая антипирены, очистку воды, фармацевтику, пестициды, нефтегазовую промышленность, фотографию и химический синтез.
Вопрос: Бром — металл?
Ответ: Нет, бром не металл. Это неметаллический элемент галогенной группы таблицы Менделеева.
