Бикарбонат калия (KHCO3) представляет собой белую кристаллическую соль, широко используемую в качестве разрыхлителя при выпечке, в качестве средства пожаротушения, для нейтрализации кислотности почвы в сельском хозяйстве. Кроме того, он действует как пищевая добавка и играет роль в конкретных медицинских процедурах.
| Название ИЮПАК | Гидрокарбонат калия |
| Молекулярная формула | KHCO3 |
| Количество CAS | 298-14-6 |
| Синонимы | Калия гидрокарбонат, соль калийной кислоты, гидрокарбонат калия, PCN 0775, E501 |
| ИнЧИ | InChI=1S/CH2O3.K/c2-1(3)4;/h(H2,2,3,4);/q;+1/p-1 |
Свойства бикарбоната калия
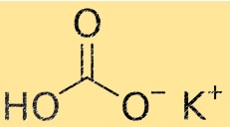
Формула бикарбоната калия
Формула бикарбоната калия KHCO3. Эта формула указывает на то, что ион калия (K+) соединяется с ионом бикарбоната (HCO3-) с образованием молекулы бикарбоната калия. Формула важна в химии, поскольку она дает информацию о типах и количестве атомов, составляющих молекулу.
бикарбонат калия Молярная масса
KHCO3 имеет молярную массу 100,115 г/моль. Это значит, что в одном моле KHCO3 содержится 100,115 грамма соединения. Молярная масса — важное свойство соединения, поскольку она используется для расчета количества вещества, необходимого для химической реакции. Кроме того, молярную массу можно использовать для преобразования граммов и молей вещества.
Температура кипения бикарбоната калия
Точка кипения KHCO3 точно не определена, поскольку он разлагается, не достигнув точки кипения. При нагревании KHCO3 разлагается на карбонат калия, углекислый газ и воду. Поэтому температура разложения KHCO3 используется для описания его термической стабильности.
Температура плавления бикарбоната калия
KHCO3 имеет температуру плавления 292°C. При этой температуре KHCO3 переходит из твердого состояния в жидкость. Температура плавления соединения является важным физическим свойством, поскольку она определяет условия, при которых соединение может плавиться и обрабатываться.
Плотность бикарбоната калия г/мл
Плотность KHCO3 составляет 2,17 г/мл. Плотность – это мера количества массы в единице объема. Высокая плотность KHCO3 делает его полезным соединением, например, в огнетушителях, где он используется для тушения пожаров класса B.
Молекулярный вес бикарбоната калия
Молекулярная масса KHCO3 составляет 100,115 г/моль. Молекулярная масса – это сумма атомных весов всех атомов молекулы. Это свойство важно в химии, поскольку оно используется для расчета количества вещества, необходимого для химической реакции.
Структура бикарбоната калия
KHCO3 имеет кристаллическую структуру, подобную хлориду натрия. Соединение состоит из ионов калия (K+) и ионов бикарбоната (HCO3-). Ионы калия занимают позиции ионов натрия в кристаллической структуре хлорида натрия, а ионы бикарбоната — позиции хлорид-ионов.
| Появление | Белый кристаллический порошок |
| Удельный вес | 2,17 г/см³ |
| Цвет | Белый |
| Запах | Без запаха |
| Молярная масса | 100,115 г/моль |
| Плотность | 2,17 г/см³ |
| Точка плавления | 292°С |
| Точка кипения | Разлагается перед кипячением |
| Мигающая точка | Непригодный |
| Растворимость в воде | 25г/100мл (20°С) |
| Растворимость | Растворим в воде |
| Давление газа | Непригодный |
| Плотность пара | Непригодный |
| пКа | 10,3 (угольная кислота) |
| рН | 8,5 – 9,5 (1% раствор) |
Безопасность и опасность бикарбоната калия
KHCO3 обычно считается безопасным при использовании по назначению. Однако он может вызвать раздражение кожи и глаз, поэтому с ним следует обращаться осторожно. Он также может быть вредным, если его проглотить в больших количествах. Вдыхание пыли может вызвать раздражение дыхательных путей. Кроме того, он может реагировать с сильными кислотами с выделением углекислого газа, что может быть опасно. При использовании KHCO3 важно соблюдать правила техники безопасности и носить соответствующее защитное оборудование. При проглатывании немедленно обратитесь за медицинской помощью. В случае попадания на кожу или в глаза тщательно промойте пораженный участок водой и обратитесь к врачу, если раздражение не исчезнет.
| Символы опасности | Никто |
| Описание безопасности | Вреден при проглатывании, вызывает раздражение кожи и глаз. Избегайте вдыхания. |
| Идентификационные номера ООН | ООН 2987 |
| код ТН ВЭД | 2836.30.00 |
| Класс опасности | 8 (Коррозионный) |
| Группа упаковки | III |
| Токсичность | LD50 (крыса, перорально): 6400 мг/кг. |
Методы синтеза гидрокарбоната калия
В присутствии воды углекислый газ реагирует с карбонатом калия с образованием KHCO3.
Реакция происходит следующим образом:
K2CO3 + CO2 + H2O → 2KHCO3
Другой метод — реакция гидроксида калия с углекислым газом:
КОН + CO2 → KHCO3
Полученный KHCO3 затем можно очистить перекристаллизацией из воды. Выход реакции зависит от чистоты сырья и условий реакции.
Для получения KHCO3 хлорид калия можно подвергнуть реакции с бикарбонатом аммония, а затем обработать диоксидом углерода.
NH4HCO3 + KCl → NH4Cl + KHCO3
KHCO3 + CO2 → K2CO3 + H2O
K2CO3 + CO2 + H2O → 2KHCO3
Преимущество этого метода заключается в использовании недорогого сырья и отсутствии опасных побочных продуктов.
Использование бикарбоната калия
KHCO3 имеет широкий спектр применения в различных отраслях промышленности и применениях. Вот некоторые из наиболее распространенных вариантов использования:
- Пищевая промышленность: используется в качестве разрыхлителя в хлебобулочных изделиях, таких как торты, печенье и хлеб, чтобы помочь им подняться.
- Сельское хозяйство: используется в качестве фунгицида для борьбы с грибковыми заболеваниями растений, такими как мучнистая роса.
- Фармацевтические препараты: используется в составе антацидов для нейтрализации желудочной кислоты и лечения расстройства желудка и изжоги.
- Огнетушители: используются в огнетушителях в качестве сухого химического агента для тушения пожаров классов B и C.
- Лабораторное применение: используется в различных лабораторных приложениях, таких как буферизация pH и клеточная культура.
- Средства личной гигиены: используется в зубных пастах в качестве мягких абразивов и в дезодорантах для контроля запахов.
- Очистка воды: используется при очистке воды для регулирования уровня pH и удаления тяжелых металлов и других примесей.
Вопросы:
Вопрос: Что такое бикарбонат калия?
Ответ: KHCO3 представляет собой белый порошок без запаха, обычно используемый в различных отраслях промышленности, таких как пищевая, сельское хозяйство и фармацевтика. Он имеет химическую формулу KHCO3 и представляет собой соль, состоящую из катиона калия, аниона бикарбоната и молекул воды.
Вопрос: Превращается ли бикарбонат калия в шипучих таблетках калия в углекислый газ?
Ответ: Да, когда шипучие таблетки калия растворяются в воде, бикарбонат в таблетке реагирует с лимонной кислотой с выделением углекислого газа. Эта реакция вызывает характерное шипение и пузырение, характерное для шипучих таблеток.
Вопрос: Что происходит после добавления в вино бикарбоната калия?
ИМЕЕТ: Добавление KHCO3 в вино снижает кислотность вина за счет реакции с избытком кислоты. Виноделы обычно используют этот процесс, называемый раскислением, для улучшения вкуса и качества вина.
Вопрос: Где купить бикарбонат калия?
О: KHCO3 можно приобрести у различных поставщиков химикатов, на интернет-рынках и в магазинах сельскохозяйственной продукции. Он также широко доступен в магазинах здорового питания и на рынках здоровой пищи.
Вопрос: Как называется соединение с формулой KHCO3?
Ответ: Соединение формулы KHCO3 называется бикарбонатом калия.
Вопрос: Что было сделано в эксперименте, чтобы гарантировать, что весь KHCO3 прореагировал?
Ответ: В эксперименте, чтобы убедиться, что весь KHCO3 прореагировал, к реакционной смеси добавляли избыток кислоты и реакция продолжалась до тех пор, пока не перестанет выделяться газ. Отсутствие газа указывало на то, что весь KHCO3 прореагировал с кислотой.
Вопрос: Что произойдет, если нагреть KHCO3?
Ответ: При нагревании KHCO3 разлагается на карбонат калия (K2CO3), воду и углекислый газ. Эта реакция протекает следующим образом: 2KHCO3 → K2CO3 + H2O + CO2.
