Бикарбонат кальция (Ca(HCO3)2) представляет собой соединение, содержащее кальций, углерод и кислород. Он обычно содержится в минеральной воде и важен для здоровья костей и функции мышц.
| Название ИЮПАК | Гидрокарбонат кальция |
| Молекулярная формула | Са(HCO3)2 |
| Количество CAS | 3983-19-5 |
| Синонимы | Гидрокарбонат кальция, гидрокарбонат кальция, гидратированный бикарбонат кальция, гидратированный гидрокарбонат кальция, EINECS 223-070-3 |
| ИнЧИ | InChI=1S/C2H2O3.Ca/c3-1(4)2(5)6;/h(H2,3,4)(H,5,6);/q;+2/p-2 |
Свойства бикарбоната кальция
Формула бикарбоната кальция
Химическая формула бикарбоната кальция: Ca(HCO3)2. Это указывает на то, что соединение состоит из одного иона Ca2+ и двух ионов HCO3-. Формула важна для понимания состава соединения и его химических свойств. Ca(HCO3)2 может образоваться при растворении карбоната кальция в газированной воде или при взаимодействии гидроксида кальция с углекислым газом.
бикарбонат кальция Молярная масса
Молярная масса Ca(HCO3)2 составляет 162,114 г/моль. Это рассчитывается путем сложения атомных масс каждого элемента в соединении. Ca(HCO3)2 содержит атомы кальция, водорода, углерода и кислорода, а молярная масса отражает общую массу всех этих атомов. Знание молярной массы важно для определения количества Ca(HCO3)2, необходимого для химических реакций, или для определения концентрации раствора.
Температура кипения бикарбоната кальция
Ca(HCO3)2 разлагается, не достигнув точки кипения. При нормальном атмосферном давлении Ca(HCO3)2 разлагается на карбонат кальция, воду и углекислый газ при температуре выше 50°С. Поэтому он не имеет точки кипения.
Температура плавления бикарбоната кальция
Ca(HCO3)2 не имеет четко выраженной температуры плавления, поскольку он разлагается, не достигнув точки плавления. При температуре выше 50°C разлагается на карбонат кальция, воду и углекислый газ. Однако термическое разложение Ca(HCO3)2 можно использовать для получения оксида кальция, имеющего высокую температуру плавления 2613°C.
Плотность бикарбоната кальция г/мл
Плотность Ca(HCO3)2 составляет 2,21 г/мл. Это означает, что один кубический сантиметр Ca(HCO3)2 весит 2,21 грамма. Плотность Ca(HCO3)2 ниже плотности карбоната кальция, которая составляет 2,71 г/мл. Плотность вещества важна при определении массы вещества в единице объема и может быть использована для расчета концентрации раствора.
Бикарбонат кальция Молекулярный вес
Молекулярная масса Ca(HCO3)2 составляет 162,114 г/моль. Это значение рассчитывается путем сложения атомных масс кальция, водорода, углерода и кислорода в соединении. Молекулярная масса важна при определении количества Ca(HCO3)2, необходимого для химических реакций, и при определении концентрации раствора.
Структура бикарбоната кальция
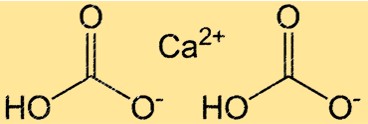
Ca(HCO3)2 имеет сложное строение из-за наличия ионных и ковалентных связей. Соединение состоит из одного иона Ca2+ и двух ионов HCO3-, связанных между собой ионными связями. Ион HCO3- сам по себе является многоатомным ионом, состоящим из одного атома углерода, двух атомов кислорода и одного атома водорода. Атом углерода связан двойной связью с одним атомом кислорода и одинарной связью с другим, а атом водорода связан с одним из атомов кислорода. Структура Ca(HCO3)2 важна для понимания его реакционной способности и растворимости в воде.
| Появление | белый порошок |
| Удельный вес | 2,21 г/см³ |
| Цвет | Бесцветный |
| Запах | Без запаха |
| Молярная масса | 162 114 г/моль |
| Плотность | 2,21 г/мл |
| Точка плавления | Разлагается при температуре выше 50°C |
| Точка кипения | Разлагается при температуре выше 50°C |
| Мигающая точка | Непригодный |
| Растворимость в воде | Растворимый |
| Растворимость | Растворим в воде, нерастворим в спирте |
| Давление газа | Незначительный |
| Плотность пара | Непригодный |
| пКа | 6,4 – 10,3 |
| рН | 8,2 – 8,4 |
Безопасность и опасность бикарбоната кальция
Регулирующие органы обычно считают Ca(HCO3)2 безопасным для использования в пищевых продуктах и напитках. Однако вдыхание пыли Ca(HCO3)2 может вызвать раздражение дыхательных путей. Контакт с глазами может вызвать раздражение или повреждение роговицы. Проглатывание большого количества Ca(HCO3)2 может вызвать раздражение желудочно-кишечного тракта. Обращение с Ca(HCO3)2 также может вызвать раздражение кожи или дерматит у чувствительных людей. При работе с Ca(HCO3)2 важно соблюдать надлежащие процедуры обращения, например, надевать перчатки и защитные очки. Кроме того, важно хранить Ca(HCO3)2 в сухом, прохладном месте, вдали от несовместимых веществ.
| Символы опасности | Никто |
| Описание безопасности | Нетоксичный и безопасный |
| Идентификационные номера ООН | Н/Д |
| код ТН ВЭД | 2836.50.00 |
| Класс опасности | Безопасно |
| Группа упаковки | Н/Д |
| Токсичность | Нетоксичный и безопасный |
Методы синтеза бикарбоната кальция
Реакция карбоната кальция (CaCO3) с углекислым газом (CO2) и водой (H2O) приводит к синтезу Ca(HCO3)2. Эта реакция может происходить естественным путем в определенных водоемах, где присутствуют углекислый газ и карбонат кальция .
Для получения Ca(HCO3)2 углекислый газ можно пропустить через раствор гидроксида кальция (Ca(OH)2) . В результате этой реакции образуется карбонат кальция , который затем реагирует с избытком углекислого газа с образованием Ca(HCO3)2.
Другой метод синтеза Ca(HCO3)2 включает взаимодействие хлорида кальция (CaCl2) с бикарбонатом натрия (NaHCO3). В результате этой реакции образуется Ca(HCO3)2, а также хлорид натрия (NaCl) и углекислый газ.
Важно отметить, что Ca(HCO3)2 является относительно нестабильным соединением и разлагается на карбонат кальция и углекислый газ в присутствии тепла или кислой среды. Во избежание разложения с Ca(HCO3)2 следует обращаться и хранить осторожно.
Использование бикарбоната кальция
Вот некоторые распространенные варианты использования Ca(HCO3)2:
- Продукты питания и напитки: Используется в качестве пищевой добавки при производстве некоторых хлебобулочных изделий, освежителей и безалкогольных напитков.
- Очистка воды: используется для повышения щелочности воды, что помогает предотвратить коррозию труб и снизить кислотность источников кислой воды.
- Сельское хозяйство: используется в качестве добавки к почве для увеличения содержания кальция в почве, что может улучшить структуру почвы и рост растений.
- Фармацевтические препараты: используется в некоторых антацидных препаратах в качестве нейтрализующего агента, помогающего облегчить изжогу и расстройство желудка.
- Строительство: используется в качестве источника кальция при производстве некоторых строительных материалов, таких как цемент и штукатурка.
- Очистка: используется в качестве мягкого абразива в некоторых чистящих средствах, таких как зубная паста и чистящие порошки.
- Косметика: используется в качестве буферного агента в некоторых косметических рецептурах для поддержания pH продукта.
Вопросы:
Вопрос: Что такое бикарбонат кальция?
Ответ: Ca(HCO3)2 представляет собой белый кристаллический порошок, образующийся при реакции карбоната кальция с диоксидом углерода и водой.
Вопрос: Какие три вещества должны взаимодействовать, чтобы образовался бикарбонат кальция?
Ответ: Карбонат кальция, углекислый газ и вода должны взаимодействовать с образованием Ca(HCO3)2.
Вопрос: Является ли бикарбонат кальция размягчающим средством?
Ответ: Да, Ca(HCO3)2 можно использовать в качестве разрыхлителя при выпечке, чтобы тесто поднялось.
Вопрос: Растворяются ли ушные кристаллы бикарбоната кальция?
Ответ: Да, аурикулярные кристаллы Ca(HCO3)2 могут растворяться сами по себе или при лечении, например, при использовании определенных лекарств или процедур.
Вопрос: Каково общее количество молей атомов в одном моле Ca(HCO3)2?
Ответ: В одном моле Ca(HCO3)2 содержится 10 молей атомов.
Вопрос: Сколько атомов в Ca(HCO3)2?
Ответ: Всего в Ca(HCO3)2 содержится 18 атомов, включая 1 атом кальция, 2 атома углерода, 6 атомов водорода и 9 атомов кислорода.
Вопрос: Что такое Ca(HCO3)2?
Ответ: Ca(HCO3)2 — это химическая формула бикарбоната кальция, соединения, образующегося при реакции карбоната кальция с диоксидом углерода и водой.
