Ацетат натрия (C2H3NaO2) представляет собой соединение, состоящее из ионов Na+ и C2H3O2-. Он обычно используется в качестве пищевой добавки и в медицинских целях, например, в растворах для диализа, а также в качестве источника углерода для некоторых бактерий.
| Название ИЮПАК | Ацетат натрия |
| Молекулярная формула | C2H3NaO2 |
| Количество CAS | 127-09-3 |
| Синонимы | Натриевая соль уксусной кислоты, этаноат натрия, натрияацетат. |
| ИнЧИ | InChI=1S/C2H4O2.Na/c1-2(3)4;/h1H3,(H,3,4);/q;+1/p-1 |
Свойства ацетата натрия
Формула ацетата натрия
Химическая формула ацетата натрия: NaC2H3O2. Это указывает на то, что соединение состоит из одного иона Na+ и одного иона C2H3O2-. Ион C2H3O2- состоит из одного атома углерода, двух атомов кислорода и трех атомов водорода. Формула полезна для определения стехиометрии химических реакций и для прогнозирования поведения соединения в различных условиях.
Молярная масса ацетата натрия
NaC2H3O2 имеет молярную массу 82,03 г/моль. Это означает, что один моль NaC2H3O2 весит 82,03 грамма. Молярная масса рассчитывается путем сложения атомных масс каждого элемента в соединении. Натрий имеет массу 22,99 г/моль, углерод имеет массу 12,01 г/моль, водород имеет массу 1,01 г/моль и кислород имеет массу 16,00 г/моль. Молярная масса NaC2H3O2 полезна при определении количества соединения, присутствующего в данном образце.
Температура кипения ацетата натрия
NaC2H3O2 имеет температуру кипения 881°C (1618°F). Точка кипения – это температура, при которой вещество переходит из жидкого состояния в газообразное. Высокая температура кипения NaC2H3O2 обусловлена прочными ионными связями между ионами натрия и ацетата. При высоких температурах эти связи разрываются и соединение испаряется.
Ацетат натрия Температура плавления
NaC2H3O2 имеет температуру плавления 324°C (615°F). Точка плавления – это температура, при которой вещество переходит из твердого состояния в жидкое. Высокая температура плавления NaC2H3O2 обусловлена также прочными ионными связями между ионами натрия и ацетата. При высоких температурах эти связи ослабляются и соединение плавится.
Плотность ацетата натрия г/мл
NaC2H3O2 имеет плотность 1,45 г/мл. Плотность – это количество массы в единице объема вещества. Высокая плотность NaC2H3O2 обусловлена компактным расположением его молекул. Плотность NaC2H3O2 может меняться в зависимости от его концентрации в растворе.
Молекулярный вес ацетата натрия
Молекулярная масса NaC2H3O2 составляет 82,03 г/моль. Это масса одного моля соединения. Молекулярная масса полезна для определения количества соединения в данном образце, а также для расчета стехиометрии химических реакций.
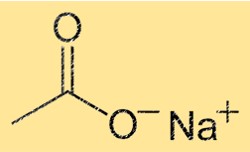
Структура ацетата натрия
NaC2H3O2 имеет кристаллическую структуру с повторяющимся звеном Na(CH3COO). Это означает, что каждая элементарная ячейка кристалла содержит один ион натрия и один ион ацетата. Ион Na+ окружен шестью атомами кислорода, а ион C2H3O2- состоит из одного атома углерода, двух атомов кислорода и трех атомов водорода. Прочные ионные связи между ионами придают кристаллу стабильность и высокие температуры плавления и кипения.
| Появление | Белое кристаллическое твердое вещество |
| Удельный вес | 1,45 при 20°С |
| Цвет | Бесцветный или белый |
| Запах | Без запаха |
| Молярная масса | 82,03 г/моль |
| Плотность | 1,45 г/см³ при 20°C |
| Точка плавления | 324°С (615°Ф) |
| Точка кипения | 881°С (1618°Ф) |
| Мигающая точка | Непригодный |
| Растворимость в воде | 820 г/л (20°С) |
| Растворимость | Растворим в воде, этаноле, ацетоне. |
| Давление газа | 1 мм рт.ст. при 239,2°C |
| Плотность пара | Непригодный |
| пКа | 4,76 (при 25°С) |
| рН | 7 (1% раствор) |
Безопасность и опасность ацетата натрия
NaC2H3O2 обычно считается безопасным в обращении и использовании при соблюдении надлежащих мер предосторожности. Однако он может вызвать раздражение кожи и глаз, а проглатывание или вдыхание больших количеств может вызвать раздражение желудочно-кишечного тракта, проблемы с дыханием и угнетение центральной нервной системы. NaC2H3O2 также может реагировать с сильными окислителями, кислотами и щелочами, выделяя тепло и опасные газы. При работе с NaC2H3O2 важно носить соответствующие средства индивидуальной защиты, включая перчатки и средства защиты глаз. NaC2H3O2 следует хранить в прохладном, сухом, хорошо вентилируемом помещении вдали от несовместимых веществ. В случае случайного воздействия или проглатывания немедленно обратитесь за медицинской помощью.
| Символы опасности | Никто |
| Описание безопасности | Избегайте контакта с кожей и глазами. Не глотать и не вдыхать. Используйте в хорошо вентилируемых помещениях. |
| Идентификационные номера ООН | Не регулируется |
| код ТН ВЭД | 2915.21.00 |
| Класс опасности | Неклассифицированный |
| Группа упаковки | Непригодный |
| Токсичность | Низкая токсичность |
Методы синтеза ацетата натрия
Существует несколько методов синтеза NaC2H3O2, но наиболее распространенный предполагает реакцию нейтрализации уксусной кислоты и гидроксида натрия . Уравнение реакции выглядит следующим образом:
CH3COOH + NaOH → CH3COONa + H2O
Для проведения реакции сначала готовят раствор уксусной кислоты, растворяя ледяную уксусную кислоту в воде. Помешивая, медленно добавляйте гидроксид натрия в раствор уксусной кислоты, пока pH раствора не достигнет примерно 7.
На этом этапе раствор будет содержать NaC2H3O2 и воду. Чтобы получить твердый NaC2H3O2, раствор можно упарить на слабом огне до высыхания. Альтернативно, раствору можно дать остыть до комнатной температуры, и кристаллы NaC2H3O2 выпадут в осадок самостоятельно.
Другой метод синтеза NaC2H3O2 включает взаимодействие уксусного ангидрида и карбоната натрия . Уравнение реакции выглядит следующим образом:
2 (CH3CO)2O + Na2CO3 → 2 CH3COONa + CO2 + CO + H2O
В результате этой реакции образуется NaC2H3O2, диоксид углерода, окись углерода и вода.
Упаривание реакционной смеси досуха и последующая ее кристаллизация в воде могут дать NaC2H3O2 в твердом виде. Высокая стоимость уксусного ангидрида делает этот метод малоприменимым.
Использование ацетата натрия
NaC2H3O2 — универсальное химическое вещество, находящее множество промышленных и научных применений. Вот некоторые из его распространенных применений:
- Буферный агент: обычно используется в качестве буферного агента в химических и биологических приложениях. Это помогает поддерживать стабильный уровень pH и предотвращать колебания кислотности.
- Нагревательные пакеты: используются при производстве грелок или грелок. Эти сумки небольшие и могут нагреваться, обеспечивая теплом определенную область тела.
- Пищевая добавка: используется в качестве пищевой добавки, главным образом в качестве усилителя вкуса, регулятора pH и консерванта. Производители обработанных пищевых продуктов обычно включают его в закуски, соусы и мясные продукты.
- Текстильная промышленность: Используется в текстильной промышленности в качестве вспомогательного средства для крашения и печати. Это помогает улучшить впитывание красителей и устойчивость цвета тканей.
- Химический синтез: используется в качестве реагента в различных химических реакциях. Он превращает спирты в соответствующие алкилгалогениды и производит уксусный ангидрид из уксусной кислоты.
- Медицинское применение: используется в медицинских целях, таких как гемодиализ, и в качестве компонента растворов электролитов.
- Фотография: используется в фотографии в качестве фиксирующего раствора для удаления неэкспонированных галогенидов серебра с фотоотпечатков и негативов.
Вопросы:
Вопрос: Какова цель ацетата натрия в синтезе амидов?
Ответ: NaC2H3O2 используется в синтезе амидов в качестве основания для депротонирования аминогруппы исходного материала. Это облегчает реакцию с карбоновой кислотой с образованием амидной связи.
Вопрос: Каково назначение раствора ацетата натрия при синтезе амидов?
Ответ: Раствор NaC2H3O2 используется в качестве основного катализатора при синтезе амида. Он помогает депротонировать аминогруппу исходного материала, делая его более реакционноспособным по отношению к карбоновой кислоте.
Вопрос: На основе ацетата натрия?
О: Да, NaC2H3O2 является основанием. Это сопряженное основание уксусной кислоты, при растворении в воде его pH составляет около 9.
Вопрос: Что такое ацетат натрия?
Ответ: NaC2H3O2 — натриевая соль уксусной кислоты с химической формулой NaCH3COO. Это белый кристаллический порошок без запаха, растворимый в воде.
Вопрос: Какова цель раствора ацетата натрия при синтезе амида ацетофенетидина?
A: При амидном синтезе ацетофенетидина раствор NaC2H3O2 используется в качестве основного катализатора для облегчения реакции между п-фенетидином и уксусным ангидридом. Он помогает депротонировать аминогруппу п-фенетидина и активировать ее для нуклеофильной атаки уксусным ангидридом. Это приводит к образованию ацетофенетидина.
