Карбонат калия (K2CO3) представляет собой белый порошок без запаха, обычно используемый в производстве мыла, стекла и керамики. Его также можно использовать в качестве пищевой добавки и буферного агента в фармацевтической промышленности.
| Название ИЮПАК | Карбонат калия |
| Молекулярная формула | К2СО3 |
| Количество CAS | 584-08-7 |
| Синонимы | Угольная кислота, двукалиевая соль; Жемчужный пепел; Поташ; Соль винного камня; монокарбонат калия; Гидрокарбонат калия |
| ИнЧИ | InChI=1S/CH2O3.2K/c2-1(3)4;;/h(H2,2,3,4);;/q;2*+1/p-2/fCO3.2K/q-2; м |
Свойства карбоната калия
Формула карбоната калия
Химическая формула карбоната калия – K2CO3. Эта формула представляет точное количество атомов каждого элемента в соединении. Формулу можно использовать для расчета молярной массы и других свойств соединения.
карбонат калия Молярная масса
K2CO3 имеет молярную массу 138,21 г/моль. Это означает, что в одном моле K2CO3 содержится 138,21 грамма соединения. Молярная масса важна для определения того, сколько вещества необходимо для конкретной реакции или эксперимента. Он также используется для преобразования массы в моли вещества.
Температура кипения карбоната калия
K2CO3 имеет относительно высокую температуру кипения — 1620 °C (2948 °F). Это делает его полезным в высокотемпературных применениях, таких как производство стекла и керамики. Точка кипения – это температура, при которой вещество переходит из жидкого состояния в газообразное.
Температура плавления карбоната калия
K2CO3 имеет температуру плавления 891°C (1636°F). Эта относительно высокая температура плавления обусловлена ионной природой соединения. Для плавления вещества при нагревании необходимо разорвать ионные связи между ионами калия и карбоната.
Плотность карбоната калия, г/мл
Плотность K2CO3 составляет 2,43 г/мл при комнатной температуре. Это означает, что определенный объем K2CO3 имеет определенную массу. Плотность вещества — важная характеристика, по которой можно идентифицировать вещество и вычислить массу или объем вещества в заданном пространстве.
Молекулярный вес карбоната калия
Молекулярная масса K2CO3 составляет 138,21 г/моль. Это масса одного моля соединения, которая важна во многих химических расчетах.
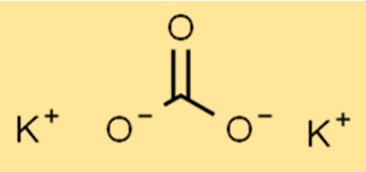
Структура карбоната калия
K2CO3 имеет ионную структуру, формулу K2CO3. Ион калия (K+) и ион карбоната (CO32-) удерживаются вместе ионными связями. Карбонат-ион представляет собой многоатомный ион, состоящий из одного атома углерода и трех атомов кислорода.
| Появление | Белый кристаллический порошок |
| Удельная плотность | 2.43 |
| Цвет | Белый |
| Запах | Без запаха |
| Молярная масса | 138,21 г/моль |
| Плотность | 2,43 г/мл |
| Точка плавления | 891 ° С (1636 ° F) |
| Точка кипения | 1620°С (2948°Ф) |
| Мигающая точка | Непригодный |
| Растворимость в воде | 112 г/100 мл при 20°С |
| Растворимость | Растворим в воде, глицерине и спирте. |
| Давление газа | Незначительно при комнатной температуре |
| Плотность пара | Непригодный |
| пКа | 10:33 утра. |
| рН | 11,5 (водный раствор 10 г/л) |
Карбонат калия: безопасность и опасности
K2CO3 обычно считается безопасным для использования в промышленности и домашнем хозяйстве. Однако он может вызывать раздражение кожи и глаз, а вдыхание порошка может вызвать раздражение дыхательных путей. Длительное воздействие высоких концентраций пыли K2CO3 может привести к повреждению легких. При работе с этим соединением важно носить соответствующие средства индивидуальной защиты, включая перчатки, очки и маску. K2CO3 не горюч и не взрывоопасен, но может вступать в реакцию с кислотами с образованием углекислого газа, который может быть опасен в замкнутых пространствах. При проглатывании или попадании на кожу или в глаза немедленно обратитесь за медицинской помощью.
| Символы опасности | Никто |
| Описание безопасности | Наденьте перчатки, очки и маску. Избегайте длительного контакта с кожей и глазами. Не вдыхайте порошок. |
| Идентификационные номера ООН | ООН1863 |
| код ТН ВЭД | 2836.40.00 |
| Класс опасности | Безопасно |
| Группа упаковки | Непригодный |
| Токсичность | Карбонат калия не считается токсичным, но в высоких концентрациях может вызывать раздражение дыхательных путей и кожи. Длительное воздействие высоких концентраций пыли может привести к повреждению легких. |
Методы синтеза карбоната калия
Различные методы позволяют синтезировать K2CO3.
Распространенным методом является реакция гидроксида калия с диоксидом углерода.
Чтобы предотвратить утечку углекислого газа, эту реакцию можно проводить в закрытом контейнере.
Другой метод включает взаимодействие хлорида калия с карбонатом натрия в водном растворе. Образующийся K2CO3 выпадает в осадок из раствора и может быть собран фильтрованием.
Другой способ синтеза K2CO3 — взаимодействие сульфата калия с углеродом в присутствии древесного угля. Исторически химики использовали процесс Леблана для производства K2CO3 в промышленных масштабах. Однако экологические проблемы сделали этот процесс сегодня редким, поскольку при нем выделяется диоксид серы.
K2CO3 можно синтезировать из бикарбоната калия, нагревая его до высоких температур, вызывая его разложение на K2CO3 и углекислый газ. Эту реакцию может осуществить духовка или духовка.
Использование карбоната калия
K2CO3 благодаря своим уникальным свойствам имеет широкий спектр применения в различных отраслях промышленности. Некоторые из его распространенных применений включают в себя:
- Производство стекла: используется в качестве флюса для снижения температуры плавления кремнезема и других ингредиентов.
- Пищевая промышленность: используется в качестве пищевой добавки для регулирования кислотности и в качестве освежителя при выпечке.
- Мыло и моющие средства: также используется при изготовлении мыла и моющих средств в качестве смягчителя воды.
- Фармацевтическая промышленность: используется в качестве буферного агента в рецептурах лекарств.
- Удобрение: также используется в качестве удобрения в сельском хозяйстве для обеспечения растений калием.
- Производство керамики: Используется в качестве флюса для снижения температуры обжига и улучшения качества готового изделия.
- Фейерверк: используется при производстве фейерверков для создания фиолетового пламени.
- Аккумуляторы: используется при производстве аккумуляторов в качестве электролита.
- Текстильная промышленность: Используется в качестве красителя.
Вопросы:
Вопрос: Растворим ли карбонат калия?
Ответ: Да, карбонат калия растворим в воде.
Вопрос: Растворим ли K2CO3 в воде?
О: Да, K2CO3 растворим в воде. Фактически, он очень растворим и может растворяться в воде с образованием прозрачного бесцветного раствора.
Вопрос: Сколько граммов карбоната калия необходимо для приготовления 200 мл 2,5 М раствора?
Ответ: Чтобы приготовить раствор 2,5 М К2СО3 в 200 мл воды, необходимо растворить в воде 33,25 грамма К2СО3.
Расчет: Молярность = моли / объем (в литрах) 2,5 М = моли / 0,2 л моль = 0,5 моль масса = моль х молярная масса масса = 0,5 моль х 138,21 г/моль масса = 33,25 г
Вопрос: Какова концентрация ионов К в растворе 0,045 М K2CO3 при условии полной диссоциации?
Ответ: Когда K2CO3 полностью диссоциирует в воде, он образует два иона K+ и один ион CO32-. Следовательно, концентрация ионов К+ в растворе 0,045 М К2СО3 будет вдвое больше молярной концентрации раствора К2СО3, которая равна 0,090 М.
