Этилацетат — бесцветная жидкость с фруктовым запахом. Он широко используется в качестве растворителя в различных отраслях промышленности, включая фармацевтическую, косметическую и пищевую. Этилацетат легко воспламеняется, поэтому с ним следует обращаться осторожно.
| Название ИЮПАК | Ацетат этила |
| Молекулярная формула | C4H8O2 |
| Количество CAS | 141-78-6 |
| Синонимы | Этиловый эфир уксусной кислоты, этилэтанолат, ацетоксиэтан, ацетидин, этилацетат, этилацетатный эфир |
| ИнЧИ | ИнЧИ=1S/C4H8O2/c1-3-6-4(2)5/h3H2.1-2H3 |
Свойства этилацетата
Плотность этилацетата г/мл
Плотность этилэтанолата составляет 0,902 г/мл при стандартных условиях температуры и давления. Эта плотность указывает на то, что этилэтаноат менее плотен, чем вода, и будет плавать на ее поверхности. Это свойство делает его полезным для разделения жидких смесей в процессе экстракции жидкость-жидкость.
Структура этилацетата
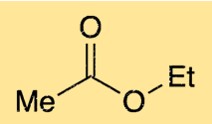
Структура этилэтанолата состоит из четырехуглеродной цепи с сложноэфирной функциональной группой. Эфирная функциональная группа состоит из атома кислорода, связанного с атомом углерода, который, в свою очередь, связан с другим атомом кислорода. Атом кислорода в сложноэфирной группе также связан с одним из атомов углерода в четырехуглеродной цепи. Такая структура придает этилэтаноату характерный фруктовый запах.
Молярная масса этилацетата
Молярная масса этилацетата составляет 88,11 г/моль. Его определяют путем сложения атомных масс всех атомов в молекуле этилацетата. Молекулярная формула этилацетата — C4H8O2, что указывает на то, что в каждой молекуле имеется 4 атома углерода, 8 атомов водорода и 2 атома кислорода. Молярная масса этилацетата используется во многих расчетах, например, при определении количества вещества в данном образце или массы вещества в заданном объеме.
Температура кипения этилацетата
Температура кипения этилэтанолата составляет 77,1°C (171,8°F) при стандартном давлении. Этилэтаноат имеет относительно низкую температуру кипения, что делает его полезным во многих промышленных применениях в качестве растворителя для экстракции, очистки и очистки. При нагревании до точки кипения этилэтанолат испаряется и может быть собран в виде чистой жидкости путем конденсации.
Температура плавления этилацетата
Температура плавления этилэтанолата составляет -83,6°C (-118,5°F). Эта низкая температура плавления означает, что этилэтаноат обычно встречается в жидкой форме, а не в твердом виде при комнатной температуре. Однако он может затвердевать при чрезвычайно низких температурах или под давлением. Твердая форма этилэтанолата обычно представляет собой белый кристаллический порошок.
Молекулярный вес этилацетата
Молекулярная масса этилэтаноата составляет 88,11 г/моль. Это значение представляет собой массу одного моля молекул этилэтанолата. Молекулярная масса используется во многих расчетах, например, при определении количества вещества в данном образце или массы вещества в заданном объеме.
Формула этилацетата
Химическая формула этилэтанолата: C4H8O2. Эта формула представляет количество и тип атомов, составляющих молекулу этилэтаноата. Четыре атома углерода в формуле расположены в цепочку, причем каждый атом углерода связан с двумя другими атомами. Два атома углерода также связаны с атомами кислорода в сложноэфирной функциональной группе. Остальные два атома углерода связаны с тремя атомами водорода.
| Появление | Бесцветная жидкость |
| Удельный вес | 0,902 г/см³ |
| Цвет | Бесцветный |
| Запах | Фруктовый, сладкий |
| Молярная масса | 88,11 г/моль |
| Плотность | 0,902 г/см³ |
| Точка плавления | -83,6°С |
| Точка кипения | 77,1°С |
| Мигающая точка | -4°С |
| Растворимость в воде | 80 г/л при 20°C |
| Растворимость | Растворим в спирте, эфире, ацетоне, хлороформе. |
| Давление газа | 73,3 мм рт.ст. при 20°C |
| Плотность пара | 3.04 |
| пКа | 4,76 |
| рН | Нейтральный |
Этилэтаноат — бесцветная жидкость, широко используемая в различных промышленных и лабораторных целях. Однако это создает определенные риски для безопасности и здоровья, которые необходимо учитывать для обеспечения безопасного обращения и использования. Воздействие этилэтанолата может вызвать раздражение глаз, кожи и дыхательной системы. Это также может вызвать головные боли, головокружение и тошноту. Этилэтаноат легко воспламеняется и может вызвать пожар или взрыв при воздействии тепла или пламени. Важно хранить и обращаться с этилэтаноатом в хорошо проветриваемом помещении, вдали от источников возгорания. В случае случайного воздействия следует немедленно обратиться за медицинской помощью, чтобы предотвратить дальнейший вред. При работе с этилэтанолатом следует использовать надлежащие меры предосторожности и защитное оборудование, чтобы свести к минимуму риск травм или повреждений.
| Символы опасности | Си, Ф |
| Описание безопасности | Избегайте контакта с кожей и глазами. Хранить вдали от источников возгорания. Используйте в хорошо проветриваемом помещении. |
| Идентификаторы сети | ООН1173 |
| код ТН ВЭД | 2915.31.00 |
| Класс опасности | 3 – Легковоспламеняющиеся жидкости |
| Группа упаковки | ГЭ II |
| Токсичность | LD50 (перорально, крыса) – 2 г/кг |
Методы синтеза этилацетата
Два основных метода — этерификация и дегидрирование — позволяют активно синтезировать этилэтаноат в промышленности с высокими выходами.
Метод этерификации включает реакцию между этанолом и уксусной кислотой в присутствии сильнокислотного катализатора, такого как серная кислота. Дистилляция разделяет этилэтаноат и воду, образующуюся в результате реакции, с получением этилэтаноата с высокими выходами, который обычно используется в промышленности.
Метод дегидрирования включает реакцию этанола и уксусной кислоты на катализаторе из оксида меди (II) при высокой температуре. Катализатор способствует дегидрированию этанола с образованием этилена, который затем реагирует с уксусной кислотой с образованием этилэтанолата. Этот метод менее распространен, чем этерификация, и обычно требует более высоких температур и более длительного времени реакции.
Другой метод синтеза этилэтанолата включает взаимодействие этанола и уксусного ангидрида. В результате этого метода получают этилэтанолат и уксусную кислоту, которые можно разделить перегонкой.
Использование этилацетата
Этилэтаноат — универсальное химическое соединение, которое широко используется в различных промышленных и потребительских целях. Некоторые из наиболее распространенных применений этилэтанолата:
- Растворитель: производители используют его в качестве мощного растворителя в красках, покрытиях и клеях.
- Ароматизатор: используется в качестве ароматизатора в пищевой промышленности и производстве напитков, особенно при производстве напитков с фруктовым вкусом.
- Ароматизатор: распространенный ингредиент духов, одеколонов и других средств личной гигиены из-за приятного фруктового запаха.
- Экстракция эфирного масла: используется для экстракции эфирных масел из растений и цветов.
- Фармацевтические препараты: используется в качестве растворителя при производстве фармацевтических препаратов, особенно при производстве антибиотиков.
- Чистящее средство: используется для очистки электронных устройств, текстиля и других материалов.
- Искусственная кожа. Производители искусственной кожи смягчают и делают материал более эластичным, используя этилацетат в качестве пластификатора.
- Химическое промежуточное соединение. Производители химической продукции создают другие химические вещества, такие как ацетат целлюлозы, винилацетат и этилакрилат, используя этилэтаноат в качестве промежуточного химического вещества.
Вопросы:
Вопрос: Является ли этилацетат полярным или неполярным?
A: Этилэтаноат является полярным растворителем из-за наличия в его молекулярной структуре карбонильной группы (C=O) и атома кислорода. Однако он не такой полярный, как другие растворители, такие как вода или этанол.
Вопрос: Смешивается ли этилацетат с водой?
Ответ: Этилэтаноат не смешивается с водой, то есть он плохо смешивается с водой. Это связано с разницей в полярности между двумя веществами, поскольку вода является высокополярным растворителем, а этилэтаноат — менее полярным растворителем.
Вопрос: Растворяется ли этилацетат в воде?
Ответ: Этилэтаноат слабо растворим в воде, его растворимость составляет около 8% при комнатной температуре. Однако эта растворимость ограничена из-за разницы в полярности между двумя веществами. Этилэтаноат лучше растворяется в неполярных растворителях, таких как гексан или толуол.
