Бензол или C6H6 — бесцветная, легковоспламеняющаяся жидкость со сладким запахом. Его используют в производстве пластмасс, синтетических волокон, каучука, пестицидов и других химикатов. Это известный канцероген, который может вызвать проблемы со здоровьем.
| Название ИЮПАК | Бензол |
| Молекулярная формула | C6H6 |
| Количество CAS | 71-43-2 |
| Синонимы | Бензол, фен, аннулен, циклогексатриен и т. д. |
| ИнЧИ | ИнЧИ=1S/C6H6/c1-2-4-6-5-3-1/h1-6H |
Свойства бензола
Молярная масса of Бензол
Бензол имеет молярную массу 78,11 г/моль. Это циклическое органическое соединение, состоящее из шести атомов углерода и шести атомов водорода. Молярную массу бензола рассчитывают путем сложения атомных масс составляющих его атомов, которые составляют 12,01 г/моль для углерода и 1,01 г/моль для водорода. Бензол широко используется в химической промышленности как сырье для производства многих важных соединений. Молярная масса бензола важна при определении количества соединения, необходимого для реакций и других применений.
Формула бензола
Бензол имеет химическую формулу C6H6. Эта формула представляет количество и тип атомов, присутствующих в молекуле. Формула бензола важна для определения его физических и химических свойств, а также реакционной способности в химических реакциях. Формула бензола также используется для названия и идентификации соединения в различных контекстах, например, в химической литературе и нормативных документах.
Температура кипения бензола
Бензол имеет температуру кипения 80,1°C или 176,2°F. Это относительно мало по сравнению с другими органическими соединениями с аналогичной молекулярной массой. Точка кипения C6H6 обусловлена его межмолекулярными силами притяжения, в частности силами Ван-дер-Ваальса. С повышением температуры кинетическая энергия молекул также увеличивается, что в конечном итоге приводит к разрушению этих межмолекулярных сил и переходу из жидкой фазы в газовую. Низкая температура кипения C6H6 делает его полезным в тех случаях, когда необходимо удалить соединение путем испарения.
Температура плавления бензола
C6H6 имеет температуру плавления 5,5°C или 41,9°F. Это относительно мало по сравнению с другими ароматическими соединениями с аналогичной молекулярной массой. Температура плавления C6H6 обусловлена его молекулярной структурой, которая состоит из плоского кольца атомов углерода с чередующимися двойными связями. Расположение электронов в кольце придает C6H6 характерную стабильность и делает его устойчивым ко многим химическим реакциям. Низкая температура плавления C6H6 делает его полезным в тех случаях, когда необходимо расплавить соединение для дальнейшей обработки.
Плотность бензола г/мл
Бензол имеет плотность 0,879 г/мл при комнатной температуре (25°C или 77°F). Плотность бензола является мерой массы единицы объема соединения. Низкая плотность бензола делает его полезным в тех случаях, когда требуется растворитель низкой плотности, например, при разделении соединений по их плотности.
Молекулярный вес бензола
Бензол имеет молекулярную массу 78,11 г/моль. Молекулярная масса бензола представляет собой сумму атомных масс составляющих его атомов. Молекулярная масса бензола важна при определении стехиометрии реакций и при определении концентрации бензола в растворах.
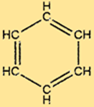
Структура бензола
C6H6 имеет уникальную структуру, состоящую из шестиугольного кольца атомов углерода, каждый из которых связан с двумя другими атомами углерода и одним атомом водорода. Чередующиеся двойные связи в кольце придают C6H6 характерную стабильность и делают его устойчивым ко многим химическим реакциям. Структура C6H6 также делает его полезным сырьем для производства многих важных соединений.
| Появление | Бесцветная жидкость |
| Удельный вес | 0,879 г/мл |
| Цвет | Бесцветный |
| Запах | Мягкий |
| Молярная масса | 78,11 г/моль |
| Плотность | 0,879 г/мл |
| Точка плавления | 5,5°С (41,9°Ф) |
| Точка кипения | 80,1°С (176,2°Ф) |
| Мигающая точка | -11°C (12,2°F) |
| Растворимость в воде | 1,79 г/л |
| Растворимость | Нерастворим в воде, растворим в органических растворителях. |
| Давление газа | 12,1 кПа при 20°C |
| Плотность пара | 2,8 (воздух=1) |
| пКа | 43,2 |
| рН | Нейтральный |
Бензол: безопасность и опасности
C6H6 — легковоспламеняющееся и токсичное соединение, представляющее значительный риск для здоровья человека и окружающей среды. Это известный канцероген, который может вызывать лейкемию, апластическую анемию и другие заболевания крови у людей. Воздействие C6H6 может происходить при вдыхании, контакте с кожей или проглатывании и может привести к острым и хроническим последствиям для здоровья. При обращении с C6H6 важно соблюдать соответствующие меры предосторожности, включая достаточную вентиляцию, защитную одежду и средства защиты органов дыхания. C6H6 также следует хранить и утилизировать в соответствии с местными правилами, чтобы свести к минимуму загрязнение окружающей среды и риски для здоровья населения.
| Символы опасности | Череп и скрещенные кости, Пламя |
| Описание безопасности | Легковоспламеняющийся, Токсичный, Канцерогенный, Вреден при проглатывании, Раздражающий. |
| Идентификаторы сети | ООН 1114 (Бензол), ООН 1992 (Легковоспламеняющиеся, токсичные жидкости) |
| код ТН ВЭД | 2902.20.00 |
| Класс опасности | 3 (Воспламеняющиеся жидкости), 6.1 (Токсичные вещества), 8 (Коррозионные вещества) |
| Группа упаковки | II (Бензол), III (Легковоспламеняющиеся, токсичные жидкости) |
| Токсичность | Острая токсичность: Очень токсично (LD50: 2,5 г/кг перорально, 0,44 мг/л при вдыхании). Хроническая токсичность: Канцерогенная, Мутагенная, Репродуктивная токсичность. |
Методы синтеза бензола
Существует несколько методов синтеза бензола, важного промышленного химиката, используемого в производстве пластмасс, резины и фармацевтических препаратов.
Одним из распространенных методов является каталитический риформинг нефтяной нафты, который включает нагревание нафты до высоких температур в присутствии катализатора, такого как платина или рений, с получением смеси ароматических углеводородов, включая бензол.
Другой метод — гидродеалкилирование толуола, который включает взаимодействие толуола с водородом в присутствии катализатора, такого как оксид хрома или оксид молибдена, для удаления метильной группы и образования бензола.
Пиролиз углеводородов, таких как уголь или нефть, при высоких температурах в отсутствие кислорода синтезирует бензол. В результате этого процесса образуется смесь ароматических углеводородов, в том числе бензола.
Другие методы синтеза бензола включают реакцию ацетилена с самим собой в присутствии катализатора, например меди, с образованием бензола, а также реакцию фенола с формальдегидом в присутствии кислотного катализатора, например серной кислоты, с образованием бензола. образуют бензол. производить бензол.
Каждый из этих методов имеет свои преимущества и недостатки в зависимости от таких факторов, как стоимость, эффективность и воздействие на окружающую среду. Выбор метода синтеза бензола будет зависеть от конкретного применения и требований производственного процесса.
Использование бензола
Бензол — универсальный и важный промышленный химикат, имеющий широкий спектр применения в различных отраслях промышленности. Некоторые из основных применений бензола:
- Производство пластмасс: используется при производстве различных видов пластмасс, в том числе полистирола, полиуретана и нейлона.
- Производство каучука: производители синтетического каучука используют его в своем производстве. Затем производители используют этот синтетический каучук для создания шин, труб, ремней и других резиновых изделий.
- Фармацевтическое производство: Используется в качестве сырья для производства различных фармацевтических продуктов, в том числе антибиотиков, антигистаминных препаратов и анальгетиков.
- Растворитель: используется в качестве растворителя для широкого спектра органических соединений, включая жиры, масла, смолы и воски.
- Топливо: используется в качестве высокооктановой присадки к топливу, улучшающей характеристики бензиновых двигателей.
- Экстракция масла: используется при экстракции масел, таких как растительные и эфирные масла, из растений.
- Клеи: используются в производстве клеев, таких как резиновый клей и контактный клей.
- Красители: Используются при производстве различных видов красителей, в том числе синтетических красителей, используемых в текстильной промышленности.
Вопросы:
Вопрос: Полярен ли бензол?
Ответ: Нет, бензол — неполярная молекула, поскольку он имеет симметричную структуру и полярности отдельных связей уравновешиваются.
Вопрос: Для чего используется бензол?
Ответ: Бензол используется в производстве различных материалов, включая пластмассы, резину, фармацевтические препараты, растворители, топливные добавки, клеи и красители.
Вопрос: Какое соединение будет проводить электричество при растворении в воде? CH4, CuSO4, C6H6 или C6H12O6?
Ответ: CuSO4 проводит электричество при растворении в воде, поскольку он диссоциирует на ионы, позволяя течь электрическому току.
Вопрос: C6H6 полярный или неполярный?
Ответ: C6H6, также известный как бензол, является неполярной молекулой, поскольку он имеет симметричную структуру и полярности отдельных связей уравновешиваются.
Вопрос: Растворим ли C6H6 в воде?
Ответ: Нет, C6H6 не растворяется в воде, поскольку это неполярная молекула и плохо взаимодействует с полярными растворителями, такими как вода.
