н-пентан — углеводород с молекулярной формулой C5H12. Используется в качестве растворителя, топлива и пенообразователя для пенопластовой изоляции. Его температура кипения составляет 36°С.
| Название ИЮПАК | Пентан |
| Молекулярная формула | C5H12 |
| Количество CAS | 109-66-0 |
| Синонимы | н-Амилгидрид, Скеллисольв А, амилгидрид, пентилгидрид, ООН 1265 |
| ИнЧИ | ИнЧИ=1S/C5H12/c1-3-5-4-2/h3-5H2.1-2H3 |
Свойства н-пентана
Температура кипения пентана
Пентан имеет температуру кипения 36,07°C (97,13°F) при стандартном давлении (1 атм). Это летучая и легковоспламеняющаяся жидкость, которая легко испаряется при комнатной температуре. Низкая температура кипения делает его полезным в качестве пенообразователя для изоляционных пен и топлива для двигателей внутреннего сгорания.
Пентановая формула
Химическая формула пентана: C5H12. Это алкан с прямой цепью, принадлежащий к группе углеводородов. Формула указывает количество и тип атомов, присутствующих в молекуле пентана. Формула пентана важна для определения его поведения в различных применениях, например, его реакционной способности с другими веществами.
Молярная масса пентана
Молярная масса пентана, также называемого нормальным пентаном, составляет 72,15 г/моль. Это алкан с прямой цепью, имеющий пять атомов углерода и 12 атомов водорода. Его молярная масса рассчитывается путем сложения атомных масс углерода и водорода в молекуле. Молярная масса пентана важна для определения количества соединения, необходимого в различных химических реакциях.
Температура плавления пентана
Пентан имеет температуру плавления -129,8°C (-201,6°F). Это бесцветная жидкость при комнатной температуре и давлении, но при низких температурах она может замерзнуть до твердого состояния. Температура плавления пентана важна для определения его поведения в различных применениях, таких как охлаждение и теплообмен.
Плотность пентана г/мл
Плотность пентана составляет 0,63 г/мл при 20°С. Это жидкость менее плотная, чем вода, и она плавает на поверхности воды. Плотность пентана важна для определения его поведения в различных применениях, таких как смешивание с другими жидкостями и его пригодность в качестве топлива.
Молекулярный вес пентана
Молекулярная масса пентана составляет 72,15 г/моль. Это сумма атомных весов всех атомов в молекуле пентана. Молекулярная масса пентана важна для определения его поведения в различных применениях, например, его растворимости в различных растворителях.
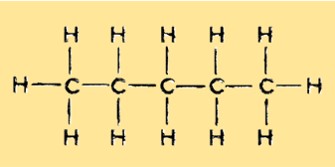
Структура пентана
Пентан имеет линейную неразветвленную структуру с пятью атомами углерода и 12 атомами водорода. Это насыщенный углеводород, принадлежащий к группе алканов. Каждый атом углерода связан с двумя атомами водорода, за исключением двух концевых атомов углерода, которые связаны с тремя атомами водорода.
| Появление | Бесцветная жидкость |
| Удельный вес | 0,626 – 0,63 при 20°С |
| Цвет | Бесцветный |
| Запах | Запах бензина |
| Молярная масса | 72,15 г/моль |
| Плотность | 0,63 г/мл при 20°C |
| Точка плавления | -129,8°C (-201,6°F) |
| Точка кипения | 36,07°С (97,13°Ф) |
| Мигающая точка | -49°C (-56,2°F) |
| Растворимость в воде | 17,5 мг/л при 20°C |
| Растворимость | Нерастворим в воде, растворим в органических растворителях. |
| Давление газа | 380 мм рт.ст. при 25°C |
| Плотность пара | 2,5 (воздух=1) |
| пКа | ~45 |
| рН | Непригодный |
Безопасность и опасность н-пентана
Н-пентан является легковоспламеняющейся жидкостью и может образовывать взрывоопасные смеси с воздухом. Он представляет опасность пожара и взрыва, поэтому с ним следует обращаться осторожно. Он может вызвать раздражение глаз, кожи и дыхательных путей, а длительное воздействие может вызвать головокружение и головные боли. При работе с н-пентаном важно использовать соответствующие средства индивидуальной защиты. В случае пожара используйте соответствующие средства пожаротушения, например, углекислый газ или сухой химический порошок. Также важно хранить н-пентан в прохладном, хорошо проветриваемом помещении, вдали от источников возгорания.
| Символы опасности | Ф, Си |
| Описание безопасности | Храните вдали от источников тепла/искры/открытого огня/горячих поверхностей. Используйте только искробезопасные инструменты. Держите контейнер плотно закрытым. Не вдыхайте пары. Избегайте контакта с глазами, кожей и одеждой. Используйте только в хорошо проветриваемом помещении. В случае пожара используйте соответствующие средства пожаротушения. |
| Идентификационные номера ООН | ООН1265 |
| код ТН ВЭД | 2901.10.00 |
| Класс опасности | 3 |
| Группа упаковки | II |
| Токсичность | Может вызвать раздражение глаз, кожи и дыхательных путей. Длительное воздействие может вызвать головокружение и головные боли. |
Методы синтеза н-пентана
Переработка нефти является основным методом производства н-пентана. Это углеводород с прямой цепью и один из основных компонентов бензина. Существует несколько методов синтеза н-пентана:
Крекинг нефти. Чтобы получить н-пентан из нефти, мы можем взломать его с помощью фракционной перегонки — процесса, при котором сырая нефть нагревается для разделения ее компонентов в зависимости от их температуры кипения. Затем мы можем отделить н-пентан от других углеводородов, температура кипения которых составляет от 30 до 40°C.
Изомеризация: Изомеризация — это процесс превращения одного углеводорода в другую формулу, имеющую ту же молекулярную структуру, но другую структуру. В результате изомеризации пентенов в качестве побочного продукта образуется н-пентан. Этот метод обычно используется в нефтехимической промышленности.
Гидрирование. Гидрирование пентена — еще один метод синтеза н-пентана. Чтобы синтезировать н-пентан из пентенов, мы можем реагировать с газообразным водородом в присутствии катализатора, которым обычно является металл, такой как никель или платина. В результате реакции образуется н-пентан в качестве побочного продукта.
Дегидратация 1-пентанола: н-пентан также можно синтезировать из 1-пентанола путем его дегидратации с использованием кислотного катализатора, такого как серная кислота . В результате этой реакции образуется н-пентен, который затем можно гидрировать с получением н-пентана.
Использование н-пентана
Н-пентан находит различное применение в различных отраслях промышленности. Вот некоторые из основных приложений:
- Растворитель: используется в качестве растворителя масел, восков и смол в лакокрасочной промышленности. Клеи, чернила и резина используют его в качестве растворителя.
- Вспениватель: используется в качестве вспенивателя при производстве пенопластовой изоляции, такой как пенополистирол (EPS) и экструдированный полистирол (XPS).
- Химическое промежуточное соединение: используется в качестве химического промежуточного продукта при производстве других химикатов, таких как пентанол, пентановая кислота и пентаналь.
- Топливо: используется в качестве топлива в некоторых бензиновых смесях, обычно в качестве компонента смеси для повышения октанового числа.
- Калибровочный стандарт: используется в качестве калибровочного стандарта в газовой хроматографии.
- Экстракция: используется при экстракции пищевых масел, таких как соевое масло, и при экстракции натуральных продуктов, таких как эфирные масла из растений.
- Лабораторные исследования: используется в лабораторных исследованиях в качестве растворителя и эталонного материала для газовой хроматографии.
Вопросы:
Вопрос: Молекулярная формула пентана — c5h12. какова молекулярная формула изомера пентана?
A: 2-Метилбутан (также известный как изопентан) имеет молекулярную формулу C5H12 и является изомером пентана.
Вопрос: Полярен ли пентан?
Ответ: Нет, пентан неполярен, поскольку содержит только неполярные связи углерод-углерод и углерод-водород и имеет симметричную молекулярную форму.
Вопрос: Что из перечисленного наиболее растворимо в воде? пентанол уксусной кислоты пентаналь бутановой кислоты
Ответ: Уксусная кислота наиболее растворима в воде из-за ее способности образовывать водородные связи с молекулами воды.
Вопрос: Растворяется ли пентан в воде?
Ответ: Нет, пентан нерастворим в воде из-за своей неполярной природы и неспособности образовывать водородные связи с молекулами воды.
Вопрос: Имеет ли н-пентан водородную связь?
Ответ: Нет, н-пентан не имеет водородной связи, поскольку в нем отсутствуют атомы водорода, связанные с электроотрицательными атомами, такими как кислород, азот или фтор.
