Диэтиловый эфир или этоксиэтан представляет собой бесцветную, легковоспламеняющуюся и летучую жидкость, которая обычно используется в качестве растворителя и исходного материала для синтеза других органических соединений.
| Название ИЮПАК | Этоксиэтан |
| Молекулярная формула | C4H10O |
| Количество CAS | 60-29-7 |
| Синонимы | Эфир, этиловый эфир, этилоксид, диэтилоксид, 1,1′-оксибисэтан, эфир, анестетический эфир, серный эфир, этиловый эфир. |
| ИнЧИ | ИнЧИ=1S/C4H10O/c1-3-5-4-2/h3-4H2.1-2H3 |
Свойства диэтилового эфира
Плотность диэтилового эфира г/мл
Плотность диэтилового эфира составляет 0,713 г/мл. Плотность определяется как масса вещества в единице объема. В случае диэтилового эфира его плотность ниже, чем у воды, плотность которой составляет 1 г/мл. Это означает, что диэтиловый эфир плавает на поверхности воды.
Молярная масса диэтилового эфира
Диэтиловый эфир имеет молярную массу 74,12 г/моль. Молярная масса – это масса одного моля вещества, выраженная в граммах. В случае этоксиэтана один моль соединения содержит 74,12 грамма. Это значение выводится из атомных масс углерода, водорода и кислорода, составляющих молекулу. Молярная масса вещества является важным параметром в химических расчетах, поскольку она используется для определения количества вещества, присутствующего в данном образце.
Структура диэтилового эфира
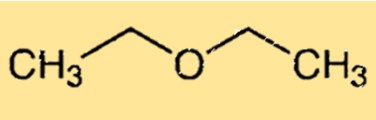
Диэтиловый эфир имеет простую химическую структуру, состоящую из двух этильных групп, присоединенных к атому кислорода. Молекула имеет изогнутую форму из-за неподеленной пары электронов на атоме кислорода, что приводит к отклонению молекулы от идеальной тетраэдрической геометрии. Изогнутая структура этоксиэтана отвечает за его способность образовывать водородные связи с другими молекулами, что делает его полезным растворителем.
Температура кипения диэтилового эфира
Температура кипения диэтилового эфира составляет 34,6°C (94,3°F). Точка кипения — это температура, при которой вещество переходит из жидкого состояния в газообразное при атмосферном давлении. Диэтиловый эфир имеет относительно низкую температуру кипения, что делает его летучей жидкостью, которая легко испаряется при комнатной температуре. Это свойство делает его полезным в качестве растворителя и анестетика в медицине.
Температура плавления диэтилового эфира
Температура плавления этоксиэтана составляет -116,3°C (-177,3°F). Точка плавления — это температура, при которой твердое вещество переходит в жидкое состояние при атмосферном давлении. Этоксиэтан представляет собой бесцветную жидкость при комнатной температуре, и его редко можно увидеть в твердом состоянии из-за его низкой температуры плавления.
Молекулярный вес диэтилового эфира
Этоксиэтан имеет молекулярную массу 74,12 г/моль. Молекулярная масса – это сумма атомных весов всех атомов молекулы. Это важный параметр в химических реакциях и стехиометрии, поскольку он определяет количество реагента, необходимое для образования определенного количества продукта.
Формула диэтилового эфира
Химическая формула этоксиэтана: C4H10O. Он состоит из четырех атомов углерода, десяти атомов водорода и одного атома кислорода. Формула представляет точное количество атомов каждого типа в молекуле и используется для определения молекулярной массы вещества. Химическая формула вещества имеет важное значение в химических уравнениях, где она используется для балансирования реакций и определения количества реагентов и продуктов.
| Появление | Бесцветная жидкость |
| Удельный вес | 0,713 |
| Цвет | Бесцветный |
| Запах | Мягкий, как эфир |
| Молярная масса | 74,12 г/моль |
| Плотность | 0,713 г/мл |
| Точка плавления | -116,3°C (-177,3°F) |
| Точка кипения | 34,6°С (94,3°Ф) |
| Мигающая точка | -45°С (-49°Ф) |
| Растворимость в воде | 6,9 г/л при 25°C |
| Растворимость | Смешивается с большинством органических растворителей. |
| Давление газа | 440 мм рт.ст. при 25°C |
| Плотность пара | 2,5 |
| пКа | 15,9 |
| рН | 7 (нейтральный) |
Диэтиловый эфир Безопасность и опасности
Этоксиэтан связан с рядом факторов безопасности и опасности, которые необходимо учитывать при обращении с ним. Он легко воспламеняется и может образовывать взрывоопасные паровоздушные смеси. Поэтому его следует хранить вдали от источников воспламенения и искр. Он также может вызвать раздражение кожи, глаз и дыхательной системы, а длительное воздействие может вызвать головокружение и головные боли. При использовании этоксиэтана необходима соответствующая вентиляция и необходимо надевать защитное оборудование, такое как перчатки и очки. Его также следует хранить в прохладном, сухом месте, вдали от окислителей и несовместимых материалов.
| Символы опасности | Ф, Си |
| Описание безопасности | С9, С16, С29, С33, С60, С61 |
| Идентификационные номера ООН | ООН 1155 |
| код ТН ВЭД | 2909.19.00 |
| Класс опасности | 3 |
| Группа упаковки | II |
| Токсичность | LD50 (перорально, крыса): 3500 мг/кг. |
Методы синтеза диэтилового эфира
Существуют различные методы синтеза диэтилового эфира, включая реакцию этанола с серной кислотой и дегидратацию этанола с использованием дегидратирующего агента, такого как серная кислота или оксид алюминия.
Чтобы синтезировать этоксиэтан методом дегидратации, нагрейте этанол с дегидратирующим агентом, таким как серная кислота или оксид алюминия, чтобы удалить молекулу воды, образуя этоксиэтан. Для улучшения выхода реакции можно использовать катализатор, такой как гидроксид калия или гидроксид натрия.
Другой метод синтеза этоксиэтана заключается в синтезе эфира Вильямсона, при котором этанол реагирует с алкоксид-ионом, таким как этоксид натрия, с образованием этоксиэтана. Эта реакция требует использования сильного основания и подходящего растворителя, такого как безводный этанол.
Другой метод получения этоксиэтана — использование реакции Тищенко. В этом процессе уксусная кислота и этанол реагируют в присутствии катализатора, такого как серная кислота или оксид алюминия, что приводит к высокому выходу этоксиэтана.
Для получения этоксиэтана в качестве конечного продукта можно использовать боргидрид натрия или амальгаму натрия для восстановления ацетальдегида. Это еще один метод синтеза этоксиэтана. Эта реакция приводит к образованию этанола , который затем может подвергнуться описанному выше методу дегидратации с образованием этоксиэтана.
Использование диэтилового эфира
Некоторые применения диэтилового эфира включают:
- Растворитель: очень эффективный растворитель для ряда органических соединений, включая масла, жиры, смолы и воски. Используется при производстве лаков, лаков и других покрытий.
- Анестетик: используется в качестве анестетика при хирургических процедурах, хотя в современной медицине он в значительной степени заменен более безопасными альтернативами.
- Экстракция: используется в качестве растворителя для экстракции при производстве фармацевтических препаратов, натуральных продуктов и эфирных масел.
- Топливная присадка: используется в качестве топливной присадки для улучшения производительности дизельных двигателей, поскольку может повысить цетановое число топлива.
- Химическое промежуточное соединение: ключевое промежуточное соединение в производстве ряда органических соединений, включая этанол, ацетальдегид и уксусную кислоту.
- Ароматизатор: используется в качестве ароматизатора при производстве некоторых продуктов питания и напитков, таких как конфеты и ликеры.
- Лабораторный реагент: используется в качестве реагента в лабораторных экспериментах, особенно в органической химии.
- Аэрозольный пропеллент: используется в качестве пропеллента в аэрозольных продуктах. Проблемы безопасности привели к постепенному отказу от этого использования.
Вопросы:
Вопрос: Полярен ли диэтиловый эфир?
Ответ: Да, этоксиэтан является полярной молекулой из-за присутствия атома кислорода, который создает частичный отрицательный заряд на одном конце молекулы и частичный положительный заряд на другом конце.
Вопрос: Смешивается ли диэтиловый эфир с водой?
Ответ: Этоксиэтан плохо растворяется в воде. Однако он считается частично смешиваемым с водой, то есть он может смешиваться с водой в некоторой степени, но не полностью.
Вопрос: Является ли диэтиловый эфир огнеопасным?
Ответ: Да, этоксиэтан легко воспламеняется и может образовывать взрывоопасные смеси с воздухом.
Вопрос: Диэтиловый эфир полярный или неполярный?
Ответ: Этоксиэтан является полярной молекулой из-за присутствия атома кислорода.
Вопрос: Является ли диэтиловый эфир полярным апротонным?
Ответ: Да, этоксиэтан считается полярным апротонным растворителем, то есть он может растворять полярные молекулы, но не имеет атома водорода, который мог бы выступать в качестве донора водородной связи.
