Хлорид аммония или NH4Cl представляет собой белую кристаллическую соль, используемую в различных областях, включая медицину и удобрения. Он образуется в результате реакции аммиака и соляной кислоты и имеет ярко выраженный соленый вкус.
| Название ИЮПАК | Хлорид аммония |
| Молекулярная формула | NH4Cl |
| Количество CAS | 12125-02-9 |
| Синонимы | Сал-аммиак, Салмиак, соль Нушадир, амхлор, Сол-арманьяк, Гидрохлорат, Мориат аммония, Сол-арманьяк |
| ИнЧИ | InChI=1S/ClH.H3N/h1H;1H3 |
NH4Cl молярная масса
Хлорид аммония имеет молярную массу 53,49 г/моль. Молярная масса относится к массе одного моля вещества и выражается в граммах на моль (г/моль). Молярную массу хлорида аммония определяют путем сложения атомных масс составляющих его атомов: азота (N), водорода (H) и хлора (Cl). Молекулярная формула хлорида аммония — NH4Cl, что означает, что он содержит один атом азота, четыре атома водорода и один атом хлора. Следовательно, молярную массу хлорида аммония можно рассчитать следующим образом:
Молярная масса = (1 x атомная масса N) + (4 x атомная масса H) + (1 x атомная масса Cl)
= (1 х 14,01 г/моль) + (4 х 1,01 г/моль) + (1 х 35,45 г/моль)
= 53,49 г/моль
Температура кипения хлорида аммония
Температура кипения хлорида аммония составляет 520°C (968°F). Точка кипения — это температура, при которой давление пара жидкости равно приложенному к ней внешнему давлению. При этой температуре хлорид аммония испаряется и переходит в газообразное состояние. Высокая температура кипения хлорида аммония обусловлена его прочными ионными связями между ионами аммония (NH4+) и хлорида (Cl-).
Температура плавления хлорида аммония
Температура плавления хлорида аммония составляет 338°C (640°F). Точка плавления – это температура, при которой твердое вещество превращается в жидкость. При этой температуре ионные связи между ионами аммония (NH4+) и хлорида (Cl-) разрываются и хлорид аммония переходит из твердого состояния в жидкость. Хлорид аммония имеет относительно низкую температуру плавления по сравнению с другими ионными соединениями, что делает его полезным в некоторых областях применения, таких как сварка и металлургия.
Плотность хлорида аммония г/мл
Плотность хлорида аммония составляет 1,527 г/см³. Плотность – это мера количества массы в единице объема вещества. Высокая плотность хлорида аммония обусловлена его очень компактной структурой ионной решетки. Хлорид аммония имеет более высокую плотность, чем вода, а это значит, что он тонет в воде.
Молекулярный вес хлорида аммония
Молекулярная масса хлорида аммония составляет 53,49 г/моль. Молекулярная масса – это сумма атомных весов всех атомов молекулы. Молекулярная масса хлорида аммония равна его молярной массе.
Структура хлорида аммония
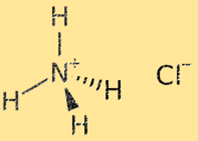
Структура хлорида аммония представляет собой кристаллическую решетку, состоящую из чередующихся ионов аммония (NH4+) и хлорида (Cl-). Ион аммония представляет собой многоатомный ион с положительным зарядом (+1), состоящий из одного атома азота и четырех атомов водорода. Хлорид-ион представляет собой одноатомный ион с отрицательным зарядом (-1), состоящий из атома хлора. Структура кристаллической решетки хлорида аммония стабилизирована прочными ионными связями между ионами аммония и хлорида, в результате чего получается очень стабильное и хрупкое твердое вещество.
Формула хлорида аммония
Формула хлорида аммония NH4Cl. Он состоит из иона аммония (NH4+) и иона хлорида (Cl-). Формула представляет соотношение атомов в молекуле и показывает, что на каждый ион аммония приходится один ион хлорида. Формула хлорида аммония используется для определения молярной массы, плотности и других свойств соединения.
| Появление | Белое кристаллическое твердое вещество |
| Удельный вес | 1527 г/см³ |
| Цвет | От бесцветного до белого |
| Запах | Без запаха |
| Молярная масса | 53,49 г/моль |
| Плотность | 1527 г/см³ |
| Точка плавления | 338°С (640°Ф) |
| Точка кипения | 520°С (968°Ф) |
| Мигающая точка | Непригодный |
| Растворимость в воде | 29,7 г/100 мл (25°С) |
| Растворимость | Растворим в этаноле и ацетоне |
| Давление газа | Непригодный |
| Плотность пара | Непригодный |
| ПКа | 9:25 утра. |
| рН | 4,6 (5% раствор) |
Безопасность и опасность хлорида аммония
Хлорид аммония (NH4Cl) обычно считается безопасным при обычном использовании. Однако он может быть вредным при проглатывании или вдыхании в больших количествах. Проглатывание NH4Cl может вызвать раздражение рта и горла, тошноту, рвоту и диарею. Вдыхание NH4Cl может вызвать раздражение дыхательных путей, кашель и одышку. С NH4Cl следует обращаться осторожно, так как он может вызвать раздражение кожи и глаз. Также важно избегать воздействия пыли или паров NH4Cl, которые могут раздражать глаза, нос и горло. При работе с NH4Cl следует надевать соответствующие средства индивидуальной защиты, такие как перчатки и очки.
| Символы опасности | XI |
| Описание безопасности | С22, С24/25, С36/37/39 |
| Идентификационные номера ООН | ООН 3077 |
| код ТН ВЭД | 2827.10.00 |
| Класс опасности | 9 – Разные опасные грузы |
| Группа упаковки | III |
| Токсичность | Низкая токсичность, но может быть вреден при проглатывании или вдыхании в больших количествах. |
Методы синтеза хлорида аммония
Хлорид аммония (NH4Cl) можно синтезировать различными методами.
- Распространенным методом является реакция газообразного аммиака с соляной кислотой в воде. В результате этой экзотермической реакции образуется NH4Cl в виде белого кристаллического твердого вещества. Важно добавлять соляную кислоту в воду медленно, помешивая, чтобы избежать разбрызгивания из-за выделяющегося тепла.
- Другой метод производства NH4Cl — это побочный продукт различных промышленных процессов, таких как производство карбоната натрия или процесс Сольвея.
- Другой способ синтеза NH4Cl — взаимодействие аммиака с хлоридом натрия. В результате этой реакции образуются как NH4Cl, так и гидроксид натрия. Эта реакция является экзотермической и требует тщательного контроля во избежание образования нежелательных побочных продуктов.
Использование хлорида аммония
Хлорид аммония (NH4Cl) находит широкое применение в различных отраслях промышленности.
- NH4Cl служит удобрением в сельском хозяйстве, обеспечивая культуры необходимыми питательными веществами, такими как азот и хлорид, тем самым улучшая урожайность и качество.
- Хлорид аммония способствует правильному функционированию сухих элементов, проводя электричество в качестве электролита.
- Текстильная промышленность использует NH4Cl в качестве красителя и средства для печати, которое помогает закреплять красители на тканях и улучшать стойкость цвета.
- В качестве флюса при металлообработке и пайке NH4Cl удаляет оксидные слои с металлов, что облегчает сварку.
- Это химическое вещество применяется в пищевой, фармацевтической и косметической промышленности в качестве ароматизатора, отхаркивающего средства в лекарствах от кашля и ингредиента средств личной гигиены.
В целом, уникальные свойства NH4Cl делают его универсальным химическим веществом, имеющим множество важных применений в различных отраслях промышленности.
Вопросы:
Вопрос: Является ли хлорид аммония возвышенным?
Ответ: Да, хлорид аммония, как известно, сублимируется, то есть он может переходить непосредственно из твердой фазы в газовую фазу, не плавясь между ними.
Вопрос: NH4Cl является кислым или основным?
Ответ: Хлорид аммония представляет собой кислую соль. При растворении в воде он может подвергаться гидролизу с образованием кислого раствора. Это связано с тем, что ион аммония действует как слабая кислота и отдает протон (H+) молекулам воды.
Вопрос: Какова формула хлорида аммония?
Ответ: Формула хлорида аммония: NH4Cl. Он состоит из иона аммония (NH4+) и иона хлорида (Cl-), удерживаемых вместе ионными связями.
Вопрос: Растворяется ли хлорид аммония в воде?
Ответ: Да, хлорид аммония хорошо растворим в воде. При комнатной температуре в 100 миллилитрах воды растворяется примерно 29,7 граммов хлорида аммония.
Вопрос: Как разделить хлорид аммония и хлорид натрия?
Ответ: Одним из способов разделения хлорида аммония и хлорида натрия является сублимация. Этого можно достичь путем нагревания смеси, в результате чего хлорид аммония сублимируется, а хлорид натрия остается в твердой форме. Сублимированный хлорид аммония затем можно собрать и повторно конденсировать в твердую форму. Другой метод заключается в растворении смеси в воде, а затем выборочном осаждении одной из солей с использованием специального реагента или регулирования pH.
