Двухосновный фосфат натрия или Na2HPO4 — это соединение, обычно используемое в качестве буферного агента в лаборатории. Его также можно найти в некоторых продуктах питания и напитках в качестве пищевой добавки.
| Название ИЮПАК | Динатрий гидрофосфат |
| Молекулярная формула | Na2HPO4 |
| Количество CAS | 7558-79-4 |
| Синонимы | Гидрофосфат натрия, динатрийфосфат, двухосновный фосфат натрия, двухосновный фосфат натрия безводный, двухосновный фосфат натрия гептагидрат |
| ИнЧИ | InChI=1S/2Na.H3O4P/c;;1-5(2,3)4/h;;(H3,1,2,3,4)/q2*+1;/p-2 |
Na2HPO4 молярная масса
Молярная масса двухосновного фосфата натрия составляет 141,96 г/моль. Это значение рассчитывается путем сложения атомных масс каждого из элементов, присутствующих в соединении, а именно натрия (Na), фосфора (P) и кислорода (O). Молярная масса — важный параметр, используемый в различных расчетах, например, для определения количества вещества, необходимого для проведения реакции или для приготовления раствора определенной концентрации.
Формула динатрийфосфата
Химическая формула двухосновного фосфата натрия: Na2HPO4. Эта формула представляет соотношение каждого из элементов, присутствующих в соединении. Формула важна для определения химических свойств соединения, таких как его реакционная способность и растворимость.
Двухосновная температура кипения фосфата натрия
Двухосновный фосфат натрия не имеет определенной температуры кипения, поскольку он разлагается, не достигнув точки кипения. Однако температура разложения двухосновного фосфата натрия будет около 155°C. При температуре выше этого значения соединение начинает распадаться на составляющие его ионы — натрий и фосфат. Это свойство делает его непригодным для использования в приложениях, требующих нагрева до высоких температур.
Температура плавления двухосновного фосфата натрия
Температура плавления Na2HPO4 варьируется в зависимости от формы, в которой он присутствует. Безводная форма соединения имеет температуру плавления 358°С, тогда как гептагидратная форма имеет более низкую температуру плавления 93°С. Температура плавления — важное физическое свойство, используемое для идентификации и характеристики веществ.
Двухосновная плотность фосфата натрия г/мл
Плотность Na2HPO4 зависит от формы, в которой он находится. Безводная форма соединения имеет плотность 1,7 г/мл, а гептагидратная форма имеет более низкую плотность — 1,68 г/мл. Плотность – это физическое свойство, которое описывает количество массы, содержащейся в определенном объеме вещества.
Двухосновная молекулярная масса фосфата натрия
Молекулярная масса Na2HPO4 составляет 141,96 г/моль. Это значение рассчитывается путем сложения атомных масс каждого из элементов, присутствующих в соединении. Молекулярная масса — важный параметр, используемый в различных расчетах, например, для определения количества вещества, необходимого для проведения реакции или для приготовления раствора определенной концентрации.
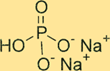
Двухосновная структура фосфата натрия
Na2HPO4 имеет кристаллическую структуру. Безводная форма соединения представляет собой белый порошок без запаха, а гептагидратная форма — бесцветный прозрачный кристалл. Соединение имеет тетраэдрическую форму вокруг атома фосфора, причем каждый атом кислорода расположен в углах тетраэдра. Ионы натрия располагаются в межузельных пространствах между тетраэдрами.
| Появление | Белый порошок или прозрачные кристаллы. |
| Удельный вес | 1,68 – 1,7 г/мл |
| Цвет | От бесцветного до белого |
| Запах | Без запаха |
| Молярная масса | 141,96 г/моль |
| Плотность | 1,68 – 1,7 г/мл |
| Точка плавления | Безводный: 358°C, гептагидрат: 93°C |
| Точка кипения | Разлагается перед кипячением |
| Мигающая точка | Непригодный |
| Растворимость в воде | Очень растворим |
| Растворимость | Растворим в воде, нерастворим в этаноле. |
| Давление газа | Непригодный |
| Плотность пара | Непригодный |
| ПКа | 2,15 (фосфат-ион) |
| PH | 8,0 – 11,0 (0,1 М водный раствор) |
Безопасность и опасность двухосновного фосфата натрия
Двухосновный фосфат натрия (Na2HPO4) обычно считается безопасным для использования в различных целях, но он может вызывать раздражение кожи и глаз. Вдыхание соединения в виде порошка может вызвать раздражение дыхательных путей. Na2HPO4 может бурно реагировать с сильными кислотами и окислителями, а также выделять токсичные пары при нагревании до высоких температур. Как и в случае со всеми химическими веществами, при работе с этим соединением следует принимать соответствующие меры предосторожности, например, носить защитную одежду и перчатки и работать в хорошо проветриваемом помещении. При попадании на кожу или в глаза промыть большим количеством воды и при необходимости обратиться к врачу.
| Символы опасности | Никто |
| Описание безопасности | S22 – Не вдыхать пыль, S24 – Избегать контакта с кожей, S37 – Надевать подходящие перчатки. |
| Идентификаторы сети | ООН3077 |
| код ТН ВЭД | 28352200 |
| Класс опасности | 9 |
| Группа упаковки | III |
| Токсичность | ЛД50 (крыса, перорально) – 3400 мг/кг |
Методы синтеза двухосновного фосфата натрия
Двухосновный фосфат натрия (Na2HPO4) можно синтезировать несколькими методами, включая реакцию фосфорной кислоты с гидроксидом натрия, нейтрализацию фосфорной кислоты карбонатом или бикарбонатом натрия и реакцию одноосновного фосфата натрия с гидроксидом натрия.
- Распространенным методом является взаимодействие фосфорной кислоты с гидроксидом натрия в соотношении 1:2 с образованием Na2HPO4 и воды. Реакцию можно проводить при комнатной температуре или при слабом нагревании, полученный продукт очищают кристаллизацией или выпариванием.
- Другой метод – нейтрализация фосфорной кислоты карбонатом или бикарбонатом натрия с последующим осаждением Na2HPO4. pH реакционной смеси доводят примерно до 8-9 с помощью карбоната или бикарбоната натрия, полученный осадок собирают и промывают водой для удаления любых примесей.
- Третий метод включает реакцию одноосновного фосфата натрия с гидроксидом натрия в соотношении 1:1, в результате чего образуются Na2HPO4 и вода. Полученный продукт затем очищают кристаллизацией или выпариванием.
Выбор метода зависит от таких факторов, как желаемая чистота, выход и экономическая эффективность. Синтез Na2HPO4 может осуществляться несколькими методами, каждый из которых имеет свои преимущества и ограничения.
Использование двухосновного фосфата натрия
Двухосновный фосфат натрия имеет множество применений в различных отраслях промышленности.
- Пищевая промышленность использует его в качестве эмульгатора, буфера и загустителя. Он действует как секвестрант, помогая сохранить качество и стабильность пищевых продуктов, предотвращая реакцию ионов металлов с другими пищевыми компонентами. Он служит в качестве разрыхлителя в разрыхлителе и регулятора pH в молочных продуктах.
- Медицинская промышленность использует его как слабительное средство для лечения запоров за счет увеличения содержания воды в толстой кишке. Он также используется при приготовлении лекарств и инъекций в качестве регулятора pH и буфера.
- В сельском хозяйстве он действует как удобрение, снабжая растения фосфором.
- Он также действует как пищевая добавка в корм для животных.
- В водоочистной промышленности Na2HPO4 используется в качестве ингибитора коррозии и ингибитора накипи в котлах и системах охлаждения.
- Действует как чистящее средство, удаляя с поверхностей отложения кальция и магния.
Вопросы:
Вопрос: Является ли двухосновный фосфат натрия консервантом?
Ответ: Na2HPO4 обычно не используется в качестве консерванта в пищевых продуктах. Однако он может действовать как секвестрант, который помогает сохранить качество и стабильность пищевых продуктов, предотвращая реакцию ионов металлов с другими пищевыми компонентами.
Вопрос: Сколько молей двухосновного фосфата натрия (массовая масса 141,98) содержится в 50 мл 20%-ного раствора?
Ответ: Чтобы рассчитать количество молей в 20% растворе Na2HPO4 (вес/объем), нам сначала необходимо преобразовать процентное соотношение вес/объем в граммы/100 мл. 20%-ный раствор означает 20 граммов соединения в 100 мл раствора. Следовательно, в 50 мл раствора содержится 10 грамм Na2HPO4. Чтобы вычислить количество молей, разделите массу на молекулярную массу:
моль = масса/молекулярный вес моль = 10 г/141,98 г/моль моль = 0,070 моль
Следовательно, в 50 мл 20%-ного раствора содержится 0,070 моль Na2HPO4.
Вопрос: Какова плотность двухосновного фосфата натрия?
Ответ: Плотность Na2HPO4 зависит от формы и концентрации соединения. Безводная форма имеет плотность примерно 2,36 г/см³, тогда как гептагидратная форма имеет плотность примерно 1,62 г/см³. В растворе плотность будет меняться в зависимости от концентрации.
