Бутаналь или бутиральдегид — органическое соединение формулы C4H8O. Это бесцветная жидкость с резким запахом, которая обычно используется в качестве сырья для синтеза других химических веществ.
| Название ИЮПАК | Бутанал |
| Молекулярная формула | C4H8O |
| Количество CAS | 123-72-8 |
| Синонимы | Бутиральдегид, масляный альдегид, бутанальдегид, бутираль, N-бутаналь, бутальдегид, бутирилгидрид, 1-бутаналь, 1-бутиральдегид |
| ИнЧИ | ИнХИ=1S/C4H8O/c1-2-3-4-5/h4H,2-3H2,1H3 |
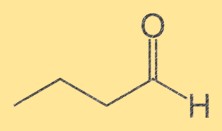
Бутанальная структура
Структура бутанала состоит из четырехуглеродной цепи с присоединенной концевой альдегидной группой (-CHO). Атомы углерода нумеруются последовательно, причем альдегидная группа присоединена к первому углероду. Структура бутанала важна, поскольку она определяет его химические и физические свойства.
Бутаналь ИК спектр
Инфракрасный (ИК) спектр бутанала используется для идентификации функциональных групп, присутствующих в молекуле. В ИК-спектре бутанала наблюдаются характерные пики карбонильной группы (-C=O) примерно при 1730 см-1 и валентных колебаний CH примерно при 2800-3000 см-1. ИК-спектр — мощный инструмент в органической химии для идентификации и характеристики соединений.
Молярная масса of бутаналь
Бутаналь имеет молярную массу 72,11 г/моль. Молярная масса соединения — это сумма атомных масс всех атомов молекулы этого соединения. В случае бутаналя молярная масса рассчитывается путем сложения атомных масс четырех атомов углерода, восьми атомов водорода и одного атома кислорода.
Температура кипения бутаналя
Температура кипения бутанала составляет 75°C или 167°F. Это температура, при которой давление паров жидкости равняется атмосферному давлению и жидкость начинает кипеть. Бутаналь имеет относительно низкую температуру кипения, что делает его летучим и легко испаряется при комнатной температуре.
Температура плавления бутаналя
Температура плавления бутанала составляет -97°C или -143°F. Это температура, при которой твердое вещество переходит в жидкое состояние. Бутаналь имеет очень низкую температуру плавления, то есть при комнатной температуре он обычно находится в жидком состоянии.
Плотность бутиральдегида г/мл
Плотность бутиральдегида составляет 0,81 г/мл. Плотность — это количество массы на единицу объема, которая для жидкостей обычно выражается в граммах на миллилитр. Бутиральдегид имеет меньшую плотность, чем вода, а это значит, что он плавает на поверхности воды.
Молекулярный вес бутиральдегида
Молекулярная масса бутиральдегида составляет 72,11 г/моль. Она равна молярной массе и представляет собой массу молекулы бутиральдегида. Молекулярная масса является важным параметром, используемым в химических расчетах и анализах.
Формула бутиральдегида
Химическая формула бутиральдегида: C4H8O. Эта формула указывает количество атомов каждого элемента в молекуле бутиральдегида. В бутиральдегиде четыре атома углерода, восемь атомов водорода и один атом кислорода.
| Появление | Бесцветная жидкость |
| Удельный вес | 0,81 г/мл |
| Цвет | Бесцветный |
| Запах | Пряный, острый |
| Молярная масса | 72,11 г/моль |
| Плотность | 0,81 г/мл |
| Точка плавления | -97°С (-143°Ф) |
| Точка кипения | 75°С (167°Ф) |
| Мигающая точка | -6,7°С (20°Ф) |
| Растворимость в воде | смешивается |
| Растворимость | Растворим в этаноле, эфире, ацетоне. |
| Давление газа | 44 мм рт.ст. при 20°C |
| Плотность пара | 2,5 (воздух=1) |
| пКа | 16.92 |
| рН | 4,5-6,5 |
Безопасность и опасность бутаналя
Бутиральдегид является легковоспламеняющейся жидкостью и может представлять опасность возгорания при воздействии тепла или пламени. При контакте он также может вызвать раздражение глаз и кожи, а вдыхание паров может вызвать раздражение дыхательных путей. Поэтому важно обращаться с бутиральдегидом осторожно, надев соответствующие средства индивидуальной защиты, такие как перчатки и очки. Хранить следует в прохладном, сухом, хорошо проветриваемом месте, вдали от источников тепла и возгорания. При попадании или проглатывании немедленно обратитесь за медицинской помощью. Также важно соблюдать надлежащие процедуры утилизации отходов бутиральдегида, чтобы предотвратить загрязнение окружающей среды.
| Символы опасности | Пламя, Коррозия, Раздражение |
| Описание безопасности | Храните вдали от источников тепла/искры/открытого огня/горячих поверхностей. Надевайте защитные перчатки/защиту глаз/лица. ПРИ ПОПАДАНИИ НА КОЖУ (или волосы): Немедленно снимите всю загрязненную одежду. Промойте кожу водой/душем. В случае возгорания: Для тушения использовать сухой химический порошок. |
| Идентификационные номера ООН | ООН1125 |
| код ТН ВЭД | 2912.19.00 |
| Класс опасности | 3 |
| Группа упаковки | II |
| Токсичность | Бутанал вреден при проглатывании, вдыхании или проникновении через кожу. Он может вызвать раздражение глаз и кожи, а длительное воздействие может привести к повреждению печени и почек. Исследования на животных также показали его мутагенные и канцерогенные свойства. Правильное обращение и утилизация важны для предотвращения воздействия и загрязнения. |
Методы синтеза бутаналя
Бутиральдегид можно синтезировать различными методами, включая окисление первичных спиртов, озонолиз алкенов и гидроформилирование алкенов.
Распространенным методом синтеза бутиральдегида является окисление первичных спиртов с использованием окислителя, такого как перманганат калия или хромовая кислота. Первичный спирт сначала преобразуется в соответствующий альдегид с использованием мягкого восстановителя, такого как хлорхромат пиридиния, а затем окисляется до бутиральдегида. Другой метод включает озонолиз алкенов с образованием альдегидов, которые затем можно восстановить до бутиральдегида с помощью восстановителя, такого как боргидрид натрия.
Гидроформилирование алкенов также является широко используемым методом синтеза бутиральдегида. Это включает реакцию алкена с окисью углерода и газообразным водородом в присутствии катализатора, такого как карбонил кобальта или комплекс родия. Полученный альдегид затем можно восстановить до бутиральдегида с помощью восстановителя, такого как литийалюминийгидрид.
Другие методы синтеза бутиральдегида включают реакцию реактивов Гриньяра с формальдегидом и реакцию кетонов с муравьиной кислотой и газообразным водородом в присутствии катализатора.
В целом выбор метода синтеза зависит от таких факторов, как доступность сырья, желаемый выход и чистота, а также осуществимость условий реакции.
Использование бутаналя
Бутанал имеет различное промышленное и коммерческое применение благодаря своей реакционной способности и отчетливому запаху.
Бутаналь в основном используется в качестве сырья для производства других химикатов, таких как бутилакрилат и н-бутанол. Эти химикаты используются в производстве покрытий, клеев и пластмасс.
Бутаналь также используется в качестве ароматизатора в пищевой промышленности, придавая фруктовый яблочный аромат различным продуктам, таким как хлебобулочные изделия, конфеты и напитки. Его также используют в качестве ароматизатора в парфюмерии и мыле.
Кроме того, бутаналь используется в качестве растворителя в органическом синтезе и в качестве реагента в реакциях органической химии. Его можно использовать для превращения альдегидов во вторичные спирты и для получения сложных эфиров путем взаимодействия с карбоновыми кислотами.
Бутанал также использовался в научных исследованиях как инструмент для понимания механизмов активации обонятельных рецепторов в мозге из-за его сильного запаха.
Однако важно отметить, что бутанал может представлять угрозу безопасности при неправильном обращении, поэтому при его использовании и хранении следует принимать соответствующие меры предосторожности. В целом, универсальность и уникальные свойства бутанала делают его важным химическим веществом в различных отраслях промышленности и областях исследований.
Вопросы:
Какова стандартная энтальпия образования жидкого бутиральдегида ch3ch2ch2cho(l)?
Стандартная энтальпия образования (∆H°f) жидкого бутиральдегида (CH3CH2CH2CHO(l)) при 25°C составляет -146,6 кДж/моль.
Это означает, что изменение энтальпии, связанное с образованием 1 моля жидкого бутиральдегида из составляющих его элементов в стандартных состояниях (в данном случае углерода, водорода и кислорода в их элементных формах), составляет -146,6 кДж/моль при 25°С. . и давление 1 атм.
Отрицательный знак указывает на то, что реакция экзотермическая, то есть с выделением тепла. Это значение полезно для расчета изменения энтальпии реакций с участием бутиральдегида в качестве реагента или продукта.
