Цинкат натрия представляет собой химическое соединение формулы Na2Zn(OH)4. Это белый твердый порошок, используемый в качестве прекурсора при синтезе наночастиц оксида цинка и в качестве реагента в органической химии.
| Название ИЮПАК | цинкат натрия |
| Молекулярная формула | Na2Zn(OH)4 |
| Количество CAS | 12179-14-5 |
| Синонимы | Гидроксид натрия-цинка, цинкат натрия, тетрагидроксицинкат натрия, цинк, тетрагидроксид |
| ИнЧИ | InChI=1S/2Na.O2Zn/c;;1-3-5-6-4-2/q2*+1;-2; |
Формула цинката натрия
Химическая формула цинката натрия — Na2Zn(OH)4, что указывает на то, что он содержит два иона натрия (Na+) и один ион оксида цинка (ZnO2-). Формула используется для представления состава соединения и может использоваться для расчета молярной массы, молекулярной массы и других свойств соединения. Формулу также можно использовать для написания химических уравнений и прогнозирования продуктов реакций с участием цинката натрия.
Молярная масса цинката натрия:
Молярную массу цинката натрия рассчитывают путем сложения атомных масс всех элементов, присутствующих в одном моле соединения. Молярная масса цинката натрия (Na2Zn(OH)4) составляет примерно 179,42 г/моль. Это значение может быть полезно при определении количества цинката натрия, необходимого для приготовления определенного количества раствора, или при определении массы соединения в данном образце.
Температура кипения цинката натрия:
Na2Zn(OH)4 представляет собой твердое соединение и не имеет температуры кипения. Однако он разлагается при высоких температурах, и образующиеся газы могут иметь температуру кипения в зависимости от их состава. Следовательно, температура кипения Na2Zn(OH)4 не является важным свойством.
Плотность цинката натрия г/мл:
Плотность Na2Zn(OH)4 составляет примерно 2,7 г/см³. Это значение может быть полезно для определения массы определенного объема Na2Zn(OH)4 или для определения объема определенной массы цинката натрия. Плотность зависит от температуры и давления и может меняться в зависимости от конкретных условий эксперимента.
Молекулярный вес цинката натрия:
Молекулярная масса Na2Zn(OH)4 рассчитывается путем сложения атомных масс всех атомов молекулы. Цинкат натрия имеет молекулярную массу примерно 179,42 г/моль. Молекулярная масса является важным свойством, поскольку она используется в расчетах, связанных с количеством цинката натрия, необходимого в реакции или рецептуре.
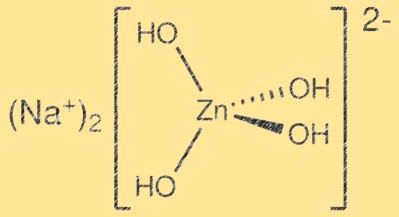
Структура цинката натрия:
Na2Zn(OH)4 имеет сложную кристаллическую структуру со слоями тетраэдров ZnO4 и октаэдров Na2O6. Тетраэдры ZnO4 имеют общие углы, образуя трехмерную решетку, а октаэдры Na2O6 занимают междоузельные пространства. Полученная структура является слоистой и может быть описана как производная от структуры вюрцита. Слои удерживаются вместе силами Ван-дер-Ваальса, и образующаяся кристаллическая структура относительно слаба.
| Появление | Белый твердый порошок |
| Удельный вес | 2,7 г/см³ |
| Цвет | Белый |
| Запах | Без запаха |
| Молярная масса | 179,42 г/моль |
| Плотность | 2,7 г/см³ |
| Точка плавления | Н/Д |
| Точка кипения | Н/Д |
| Мигающая точка | Н/Д |
| Растворимость в воде | Растворимый |
| Растворимость | Растворим в воде, нерастворим в органических растворителях. |
| Давление газа | Н/Д |
| Плотность пара | Н/Д |
| пКа | Н/Д |
| рН | Щелочная (pH > 7) |
Обратите внимание, что некоторые свойства, такие как температура вспышки и давление паров, не имеют отношения к цинкату натрия, поскольку он представляет собой твердое соединение.
Безопасность и опасность цинката натрия
Na2Zn(OH)4 представляет определенные риски для безопасности и опасности, которые необходимо учитывать при обращении с этим соединением. При работе с Na2Zn(OH)4 важно носить соответствующие средства индивидуальной защиты, такие как перчатки и защитные очки. Соединение может вызвать раздражение кожи и глаз, а проглатывание может привести к расстройству желудочно-кишечного тракта. Na2Zn(OH)4 также может представлять опасность возгорания, поэтому его следует хранить в прохладном, сухом месте, вдали от источников тепла и источников возгорания. Правильное обращение и хранение Na2Zn(OH)4 может помочь минимизировать риски, связанные с этим соединением.
| Символы опасности | Никто |
| Описание безопасности | S22: Не дышите пылью. S24/25: Избегать попадания на кожу и в глаза. S37/39: Надевайте подходящие перчатки и средства защиты глаз/лица. |
| Идентификационные номера ООН | Непригодный |
| код ТН ВЭД | 2834,29 |
| Класс опасности | Не классифицируется как опасный |
| Группа упаковки | Непригодный |
| Токсичность | Точная токсичность цинката натрия точно не изучена, но он может вызывать раздражение кожи и глаз и может быть опасен при проглатывании. Важно обращаться с составом осторожно и носить соответствующие средства индивидуальной защиты. |
Методы синтеза цинката натрия
Существует несколько методов синтеза Na2Zn(OH)4, но наиболее распространенный метод предполагает смешивание оксида цинка и гидроксида натрия в водном растворе. Сначала нужно смешать оксид цинка с гидроксидом натрия в водном растворе. Затем нагрейте и перемешайте смесь до образования прозрачного раствора. После охлаждения раствора из раствора выпадет в осадок Na2Zn(OH)4, который необходимо промыть водой и высушить для получения конечного продукта.
Другой способ синтеза Na2Zn(OH)4 — добавить цинк в раствор гидроксида натрия и нагревать смесь до образования прозрачного раствора. После охлаждения раствора из раствора выпадет в осадок Na2Zn(OH)4, который необходимо промыть водой и высушить для получения конечного продукта.
Крайне важно проводить синтез Na2Zn(OH)4 в хорошо проветриваемом помещении и носить соответствующие средства индивидуальной защиты. Также следует соблюдать осторожность при обращении с гидроксидом натрия, поскольку он может вызывать коррозию и вызывать раздражение кожи и глаз.
Применение цинката натрия
В различных отраслях промышленности Na2Zn(OH)4 используется для различных целей. Одно из его основных применений — использование в качестве прекурсора для синтеза оксида цинка, который производители используют при производстве резины, керамики и других изделий. Na2Zn(OH)4 действует как стабилизатор при производстве синтетических волокон и пластмасс.
В сельском хозяйстве фермеры используют Na2Zn(OH)4 в качестве удобрения, чтобы обеспечить растения необходимыми питательными веществами, такими как цинк. Он также может защитить посевы от грибковых заболеваний, выступая в качестве фунгицида.
Производители пигментов, таких как цинковый желтый, используют в своем производстве Na2Zn(OH)4, который обычно используется в красках и покрытиях. Кроме того, промышленность использует Na2Zn(OH)4 в качестве ингибитора коррозии для защиты металлов от коррозии.
В фармацевтической промышленности Na2Zn(OH)4 служит источником цинка, важного питательного вещества для здоровья человека. Цинк является важным элементом в различных биологических процессах, играя важную роль в поддержании здоровой иммунной системы и способствуя заживлению ран.
В целом, Na2Zn(OH)4 имеет ряд важных применений в различных отраслях промышленности и представляет собой универсальное соединение с множеством потенциальных применений.
Вопросы:
Цинкат натрия – это соль?
Цинкат натрия считается солью, поскольку он образует ионное соединение в результате реакции металла (цинка) и основания (гидроксида натрия). Электростатические силы удерживают вместе положительно заряженные ионы цинка и отрицательно заряженные ионы натрия и гидроксида. Соли – это ионные соединения, образующиеся в результате реакции между кислотой и основанием или металлом и неметаллом. Хотя Na2Zn(OH)4 не образуется в результате реакции кислоты и основания, тем не менее он соответствует общему определению соли как ионного соединения.
