Что такое аммиак?
Аммиак или NH3 — бесцветный резкий газ, состоящий из азота и водорода, широко используемый в промышленности в качестве хладагента, чистящего средства и удобрения.
| Название ИЮПАК | Аммиак |
| Молекулярная формула | NH3 |
| Количество CAS | 7664-41-7 |
| Синонимы | Азан, тригидрид азота, спирт Хартсхорна. |
| ИнЧИ | ИнЧИ=1S/NH3/c1-2 |
Свойства аммиака
Структура Льюиса для аммиака
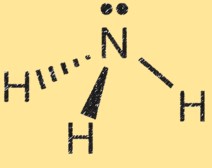
Структура Льюиса аммиака (NH3) показывает расположение электронов в молекуле. В структуре Льюиса точки представляют электроны, а линии представляют связи между атомами.
Структура Льюиса аммиака показывает атом азота, окруженный тремя атомами водорода и парой электронов, общими для атомов азота и водорода. Это представляет собой ковалентные связи в молекуле. Атом азота имеет пять валентных электронов, а атомы водорода — по одному валентному электрону. В структуре Льюиса аммиака атом азота образует три одинарные связи с атомами водорода и имеет одну неподеленную пару электронов.
Формула аммиака
Химическая формула аммиака – NH3. Формула указывает на то, что в каждой молекуле аммиака имеется три атома водорода и один атом азота. Формула представляет состав вещества и дает важную информацию о его свойствах и поведении.
NH3 Молярная масса
Молярная масса вещества равна массе одного моля вещества и выражается в граммах на моль. Молярная масса аммиака (NH3) составляет 17,0307 г/моль. Это означает, что один моль аммиака имеет массу 17,0307 грамма. Молярная масса вещества важна для определения количества молей в данном образце и может использоваться для определения формульной массы соединения.
Температура кипения аммиака
NH3 имеет температуру кипения -33,34°C (-28,012°F). Точка кипения вещества — это температура, при которой давление его пара становится равным атмосферному давлению и оно начинает переходить из жидкого состояния в газообразное. Температура кипения NH3 относительно низкая по сравнению с другими химическими веществами, что делает его полезным хладагентом в системах охлаждения и охлаждения.
NH3 Точка плавления
NH3 имеет температуру плавления -77,73°C (-107,87°F). Температура плавления вещества – это температура, при которой оно переходит из твердого состояния в жидкое. Низкая температура плавления NH3 делает его полезным хладагентом, поскольку он легко конденсируется из газа в жидкость, что позволяет ему поглощать тепло при изменении состояния.
NH3 Плотность г/мл
Плотность вещества – это масса образца в единице объема. Плотность NH3 составляет 0,769 г/мл. Это означает, что один миллилитр NH3 имеет массу 0,769 грамма. Плотность вещества может использоваться для определения количества вещества, присутствующего в данном объеме, и является важным свойством для понимания того, как вещество ведет себя в разных состояниях.
NH3 Молекулярный вес
Молекулярная масса вещества представляет собой сумму атомных весов всех атомов в одной молекуле вещества. Молекулярная масса NH3 (NH3) составляет 17,0307 г/моль. Это означает, что молекула NH3 имеет молекулярную массу 17,0307 грамма на моль. Молекулярная масса вещества важна для определения количества молей в данном образце и может использоваться для определения формульной массы соединения.
Структура NH3
NH3 представляет собой молекулу, состоящую из трех атомов водорода и одного атома азота. Атом азота связан с атомами водорода ковалентной связью, и молекула имеет форму тригональной пирамиды. Валентные углы в молекуле составляют примерно 107°. NH3 — полярная молекула, то есть у нее есть положительный и отрицательный конец, и она обычно используется в качестве растворителя и реагента в химических реакциях.
| Появление | Бесцветный газ |
| Удельный вес | 0,59 (воздух = 1) |
| Цвет | Бесцветный |
| Запах | Резкий и сильный запах |
| Молярная масса | 17,0307 г/моль |
| Плотность | 0,769 г/мл |
| Точка плавления | -77,73°С |
| Точка кипения | -33,34°С |
| Мигающая точка | Не применимо (газ) |
| Растворимость в воде | Очень растворим |
| Растворимость | Растворим в воде и большинстве органических растворителей. |
| Давление газа | 50,7 кПа при 20°C |
| Плотность пара | 0,59 (воздух = 1) |
| пКа | 4,75 |
| рН | 11,6 (насыщенный раствор) |
Безопасность и опасности аммиака
NH3 — высокотоксичный и едкий газ, который при неправильном обращении может нанести серьезный вред здоровью человека и окружающей среде. NH3 может вызвать серьезные ожоги глаз, кожи и дыхательных путей, а также может быть смертельным при вдыхании в высоких концентрациях. Кроме того, NH3 очень реактивен и может воспламениться или взорваться при контакте с определенными химикатами или материалами.
Важно принять меры предосторожности при обращении или работе с NH3. Это включает в себя ношение защитной одежды, такой как перчатки, очки и маска, а также обеспечение достаточной вентиляции, чтобы избежать вдыхания газа. Также важно хранить NH3 в хорошо вентилируемых помещениях, вдали от источников тепла и других легковоспламеняющихся материалов. При воздействии NH3 важно снять загрязненную одежду и промыть пораженный участок большим количеством воды. При появлении симптомов воздействия немедленно обратитесь за медицинской помощью.
| Символы опасности | Т+, Н |
| Описание безопасности | Опасен для окружающей среды, вреден при вдыхании, раздражает. |
| Идентификаторы сети | ООН 1005 |
| код ТН ВЭД | 2814,1 |
| Класс опасности | 2.3 |
| Группа упаковки | II |
| Токсичность | Высокотоксичная и смертельная доза (ингаляционная) – 33-66 ppm. |
Методы синтеза аммиака
Существует несколько методов синтеза аммиака, включая процесс Габера, процесс Оствальда и процесс Биркеланда-Эйда.
Процесс Габера, также известный как процесс Габера-Боша, является наиболее широко используемым методом промышленного синтеза аммиака. В этом процессе газообразный азот из воздуха реагирует с газообразным водородом над железным катализатором с образованием аммиака. Реакция протекает под высоким давлением (около 150 атмосфер) и температуре 450-500°С. Процесс Габера очень эффективен, производит большое количество аммиака с высоким выходом и используется в качестве основного источника аммиака для производства удобрений и других химикатов.
Процесс Оствальда, также известный как процесс фиксации азота, представляет собой более старый метод синтеза аммиака, который включает окисление газообразного азота до оксида азота с последующей реакцией оксида азота с большим количеством газообразного азота с образованием аммиака. Этот процесс менее эффективен и в значительной степени заменен процессом Габера.
Процесс Биркеланда-Эйда, также известный как плазменный процесс, представляет собой новый метод синтеза аммиака, в котором используется плазменный разряд для диссоциации газов азота и водорода и образования аммиака. Этот процесс все еще находится на стадии разработки и не получил широкого распространения в промышленности.
Таким образом, процесс Габера является наиболее часто используемым методом синтеза аммиака, тогда как процесс Оствальда и процесс Биркеланда-Эйда являются более старыми или менее широко используемыми методами.
Использование аммиака
Аммиак – универсальное химическое вещество, имеющее широкий спектр применения в промышленности и сельском хозяйстве. Некоторые из основных применений аммиака включают в себя:
- Производство удобрений: аммиак, основной ингредиент при производстве азотных удобрений, повышает урожайность сельскохозяйственных культур и улучшает плодородие почвы.
- Охлаждение. В промышленных и бытовых холодильных системах в качестве хладагента используется аммиак, включая холодильники и морозильники.
- Очистка: бытовые чистящие средства часто содержат аммиак из-за его способности растворять жир и грязь.
- Фармацевтика: при производстве различных фармацевтических продуктов, таких как антациды и сиропы от кашля, в качестве сырья используется аммиак.
- Текстильное производство: при крашении и печати тканей, а также при производстве синтетических волокон используется аммиак.
- Очистка отходов: Очистка сточных вод и борьба с запахами на очистных сооружениях включают использование аммиака.
- Антипирены: аммиак действует как антипирен при производстве таких материалов, как пластмассы, резины и других.
- Добыча нефти и газа. В нефтегазовой промышленности аммиак используется для производства различных химикатов, включая поверхностно-активные вещества и деэмульгаторы.
В заключение отметим, что аммиак — это универсальное химическое вещество, которое имеет широкий спектр применения в различных отраслях промышленности и применениях, включая сельское хозяйство, холодильное оборудование, очистку, фармацевтику, текстильное производство, переработку отходов, антипирены и добычу нефти и газа.
Вопросы:
Аммиак – это кислота или основание?
Аммиак считается основанием. В водных растворах он растворяется с образованием гидроксид-ионов (OH-) и действует как слабое основание. Аммиак имеет основной (щелочной) pH, обычно около 11. Растворы аммиака могут нейтрализовать кислоты с образованием соли и воды, что является одной из определяющих характеристик основания. В химических реакциях аммиак может выступать также как нуклеофил и участвовать в реакциях с образованием амидов, которые являются производными аммиака и содержат связь азот-углерод, характерную для аминов и амидов.
Полярен ли аммиак?
Да, аммиак полярен. Он имеет изогнутую молекулярную геометрию с центральным атомом азота, окруженным тремя атомами водорода. Эта форма создает постоянный дипольный момент, при этом положительный конец диполя расположен у атомов водорода, а отрицательный конец — у атома азота. Полярная природа аммиака позволяет ему растворяться в полярных растворителях, таких как вода, что характерно для полярных молекул. Полярная природа аммиака также позволяет ему участвовать в водородной связи, которая представляет собой тип межмолекулярной силы, возникающей между полярными молекулами. Эта водородная связь может привести к более высоким температурам кипения и плавления, чем у неполярных молекул аналогичного размера.
