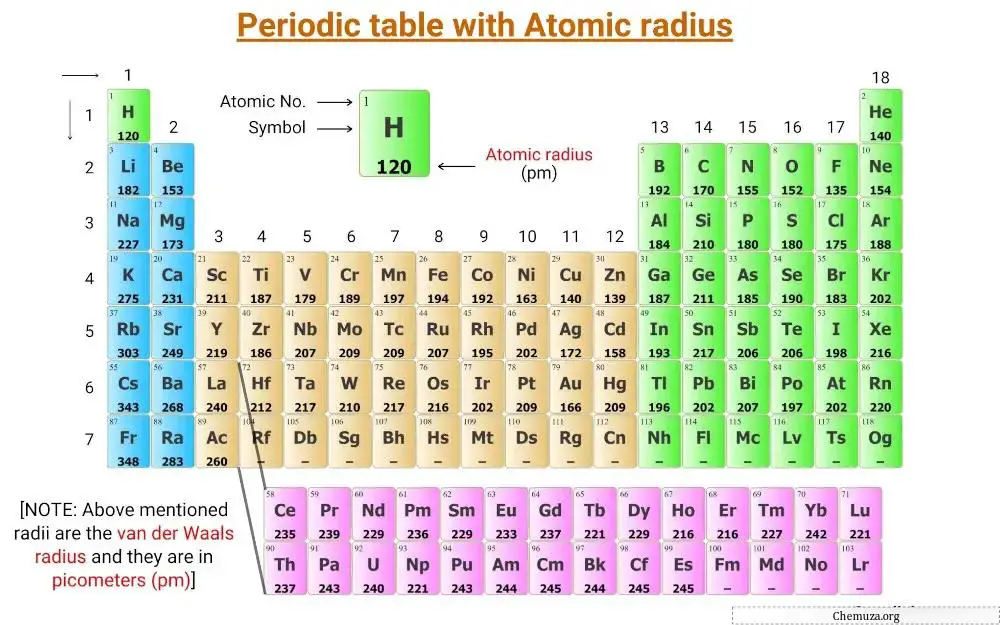
Это таблица Менделеева с нанесенными на нее значениями атомных радиусов элементов.
Радиусы, упомянутые в таблице Менделеева выше, представляют собой радиус Ван-дер-Ваальса и выражены в пикометрах (пм).
Что ж, есть несколько важных концептуальных вещей об атомном радиусе элементов, которые вам следует знать.
Итак, давайте перейдем непосредственно к делу.
Что такое атомный радиус?
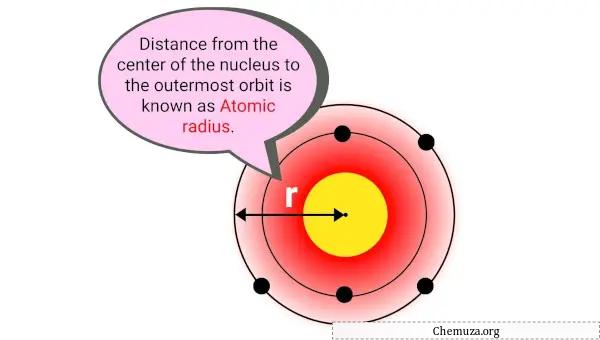
Атомный радиус — это расстояние между центром ядра атома и самым внешним электроном в его электронном облаке.
Проще говоря, это размер атома. Атомный радиус обычно измеряется в пикометрах (пм) или одной триллионной метра.
Атомы чрезвычайно малы, и их трудно визуализировать, но концепция атомного радиуса помогает нам понять, как атомы взаимодействуют друг с другом и как они ведут себя в различных химических реакциях.
Размер атома может влиять на его химические свойства , например, на то, как он связывается с другими атомами или молекулами .
Как измерить атомный радиус?
Атомный радиус обычно измеряется с использованием различных экспериментальных методов, таких как рентгеновская кристаллография, дифракция электронов и спектроскопия.
Эти методы включают изучение поведения атомов, когда они взаимодействуют с определенными формами энергии, такими как рентгеновские лучи или электроны.
- В рентгеновской кристаллографии пучок рентгеновских лучей направляется на кристалл изучаемого элемента. Рентгеновские лучи преломляют атомы в кристалле, и полученную дифракционную картину можно использовать для определения расстояния между атомами и, следовательно, их радиусов.
- При дифракции электронов пучок электронов направляется на тонкую пленку исследуемого элемента. Проходя через пленку, электроны рассеивают атомы, создавая дифракционную картину, которую можно проанализировать для определения атомного радиуса.
- Спектроскопия предполагает изучение взаимодействия света и вещества. Анализируя длины волн света, поглощаемого или излучаемого атомом, ученые могут определить его атомный радиус.
Факторы, влияющие на атомный радиус
На размер атома влияют различные факторы, в том числе:
- Ядерный заряд
- Электронная конфигурация
- Расстояние валентных электронов от ядра и т. д.
Ядерный заряд
Число протонов в ядре атома называется атомным номером. [1]
По мере увеличения атомного номера число протонов в ядре увеличивается, что приводит к увеличению заряда ядра.
Этот увеличенный заряд сильнее притягивает электроны к ядру, что приводит к меньшему радиусу атома.
Электронная конфигурация
То, как электроны расположены вокруг ядра атома, определяет его электронную конфигурацию. [2]
Чем ближе электроны к ядру, тем меньше радиус атома.
Атомы с большим количеством электронов на самом внешнем энергетическом уровне (валентной оболочке) будут иметь больший атомный радиус, потому что электроны находятся дальше от ядра и менее сильно притягиваются к нему.
Расстояние валентных электронов от ядра
Расстояние между валентными электронами и ядром также влияет на радиус атома.
По мере увеличения числа электронных оболочек валентные электроны удаляются от ядра, что приводит к увеличению атомного радиуса.
Важно отметить, что факторы, влияющие на атомный радиус, взаимосвязаны. Например, хотя увеличение заряда ядра приведет к уменьшению атомного радиуса, увеличение числа электронов на самом внешнем энергетическом уровне (валентной оболочке) приведет к увеличению атомного радиуса. Следовательно, общий размер атома является результатом баланса между этими факторами.
Для получения дополнительной информации вам следует прочитать тенденции атомных радиусов в таблице Менделеева.
Краткое содержание
Атомный радиус — это размер атома, измеряемый в пикометрах, от центра ядра до самого дальнего электрона в электронном облаке.
Это помогает нам понять, как атомы взаимодействуют и влияют на их химические свойства. Для измерения атомного радиуса используются экспериментальные методы, такие как рентгеновская кристаллография, дифракция электронов и спектроскопия.
Факторами, влияющими на радиус атома, являются заряд ядра, электронная конфигурация и расстояние между валентными электронами и ядром. Эти факторы взаимосвязаны и определяют общий размер атома.
