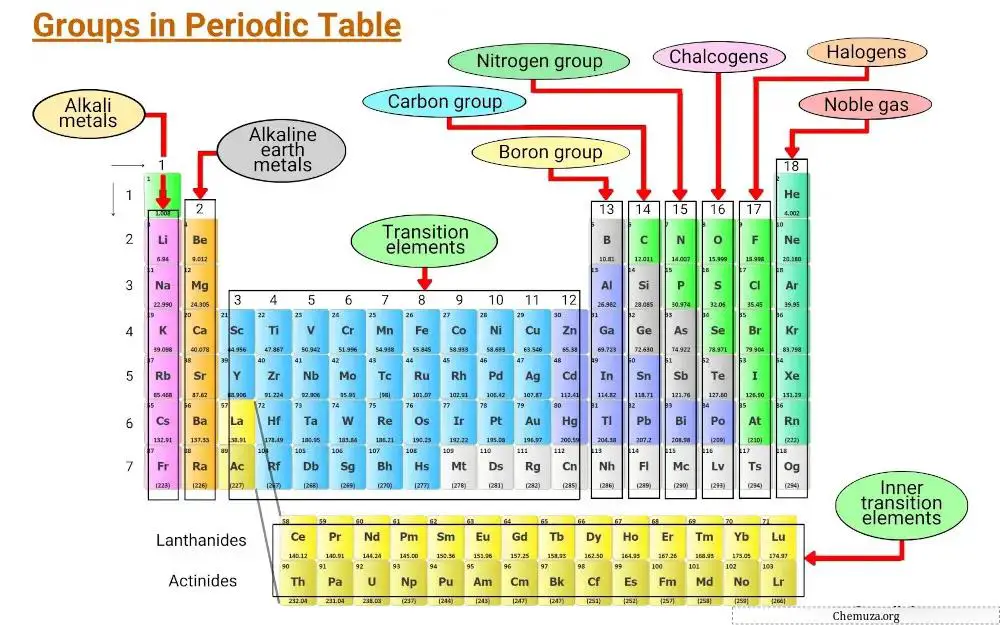
Элементы группируются на основе общих характеристик, включая электронную конфигурацию и поведение валентных электронов.
Вертикальные столбцы таблицы Менделеева называются группами, а в таблице Менделеева 18 групп, каждая из которых имеет свой набор свойств, определяющих, как элемент будет взаимодействовать с другими элементами и образовывать соединения.
В этой статье мы рассмотрим различные группы периодической таблицы.
Давайте сразу к делу!.
Группа 1: Щелочные металлы
Группа 1 периодической таблицы известна как щелочные металлы .
В эту группу входят литий, натрий, калий, рубидий, цезий и франций.
Щелочные металлы известны своей мягкостью, низкой температурой плавления и высокой реакционной способностью с водой и воздухом.
Щелочные металлы очень реакционноспособны, поскольку в их внешней оболочке имеется только один электрон, который они легко отдают, образуя положительные ионы. [1]
Это делает их отличными проводниками электричества и полезными во многих применениях, включая батареи и промышленные процессы.
Однако из-за их высокой реакционной способности с щелочными металлами следует обращаться осторожно. Они могут самовозгораться на воздухе и взрывоопасно реагировать с водой, выделяя газообразный водород. [2]
Группа 2: Щелочноземельные металлы.
Группа 2 таблицы Менделеева известна как « щелочноземельные металлы ». В эту группу входят шесть элементов: бериллий, магний, кальций, стронций, барий и радий.
Эти металлы называются «щелочными», потому что они реагируют с водой с образованием щелочных (основных) растворов .
Щелочноземельные металлы обладают схожими свойствами, включая высокие температуры плавления и кипения, низкую плотность и способность легко образовывать ионы с зарядом +2.
Они также очень реакционноспособны, особенно с водой и кислородом. Однако, в отличие от щелочных металлов 1-й группы, они менее реакционноспособны и имеют более высокую температуру плавления.
Эти элементы содержатся во многих предметах повседневного обихода, включая кости (кальций), фейерверки (стронций) и детали самолетов (магний).
Щелочноземельные металлы также используются в промышленных процессах, таких как производство алюминия и стали.
Группа 3–11: Переходные металлы.
Группы с 3 по 11 периодической таблицы известны как группа переходных металлов . Эти металлы обладают уникальными характеристиками, которые отличают их от других предметов на столе.
Одной из определяющих характеристик переходных металлов является их способность образовывать окрашенные соединения.
Это связано с их уникальными электронными конфигурациями, которые позволяют им поглощать и отражать свет определенных длин волн. [3]
Переходные металлы также известны своими высокими температурами плавления и кипения, а также прочностью и долговечностью.
Их часто используют в строительных материалах, электропроводке и даже в ювелирных изделиях.
Группа 13: группа бора.
Группа 13 таблицы Менделеева известна как группа бора и включает элементы бор (B), алюминий (Al), галлий (Ga), индий (In), таллий (Tl) и нихоний (Nh).
Эти элементы имеют определенные общие характеристики, которые делают их химически схожими.
Бор — единственный металлоид в этой группе, то есть он обладает как металлическими, так и неметаллическими свойствами.
Группа 14: Группа углерода.
Группа 14 периодической таблицы известна как группа углерода и включает углерод (C), кремний (Si), германий (Ge), олово (Sn), свинец (Pb) и флеровий (Fl).
Эти элементы имеют схожие свойства, поскольку все они имеют четыре валентных электрона.
Углерод — очень важный элемент, поскольку он составляет основу всех органических молекул, включая строительные блоки жизни, такие как белки и ДНК. [4]
Группа 15: Пниктогены
Группа 15 таблицы Менделеева также известна как группа азота (или пниктогены).
В эту группу входят 6 элементов: азот (N), фосфор (Р), мышьяк (As), сурьма (Sb), висмут (Bi) и московий (Mc).
Элементы группы 15 имеют пять валентных электронов в своей внешней электронной оболочке, что означает, что они имеют тенденцию образовывать три ковалентные связи для завершения своего октета.
Они также имеют тенденцию приобретать три электрона с образованием анионов . Элементы в группе становятся менее неметаллическими и более металлическими.
Группа 16: Халькогены
Группа 16 таблицы Менделеева известна как кислородная группа. В него входят элементы кислород (О), сера (S), селен (Se), теллур (Te), полоний (Po) и печеночный (Lv).
Эти элементы имеют общие характеристики, в том числе наличие шести валентных электронов на самом внешнем энергетическом уровне.
Кислород является наиболее распространенным элементом этой группы и необходим для жизни, поскольку он является ключевым компонентом воды и многих органических молекул.
Элементы кислородной группы могут образовывать соединения со многими другими элементами, включая металлы и неметаллы .
Группа 17: Галогены
Группа 17 таблицы Менделеева также известна как группа галогенов . В его состав входят шесть элементов: фтор, хлор, бром, йод, астат и теннессин.
Все галогены имеют семь электронов на внешней оболочке, также известной как валентная оболочка. Это делает их очень реакционноспособными, поскольку им нужен всего один дополнительный электрон, чтобы завершить внешнюю оболочку и стать стабильными.
Еще одной важной характеристикой галогенов является то, что все они неметаллы, то есть не проводят электричество и не являются ковкими или пластичными, как металлы.
Они также существуют во всех трех состояниях вещества при комнатной температуре: фтор и хлор представляют собой газы, бром — жидкость, а йод и астат — твердые вещества.
Группа 18: Редкие газы
Группа 18 таблицы Менделеева также известна как благородные газы .
Благородные газы включают гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радон (Rn).
Эти газы называются благородными, потому что они очень стабильны и трудно вступают в реакцию с другими элементами.
Благородные газы расположены в крайнем правом столбце таблицы Менделеева, и все они имеют полную внешнюю электронную оболочку, что делает их очень нереакционноспособными.
Они также не имеют запаха, бесцветны и имеют низкие температуры кипения и плавления.
