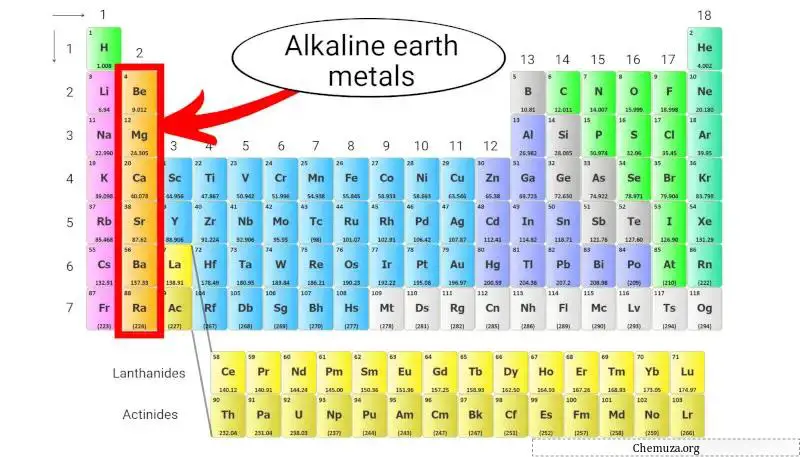
Щелочноземельные металлы — группа элементов, расположенных во втором столбце таблицы Менделеева . К ним относятся бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Эти металлы имеют два электрона в своей внешней оболочке, [1] что делает их химически активными, но не такими реакционноспособными, как щелочные металлы , которые находятся в первом столбце.
Давайте узнаем больше о щелочноземельных металлах в таблице Менделеева.
Что такое Щелочноземельные металлы?

Щелочноземельные металлы входят во 2-ю группу таблицы Менделеева и обладают двумя особыми характеристиками.
- Когда они реагируют с водой, они образуют гидроксиды щелочной или основной природы.
- Их оксидные минералы (BeO, магнезит, MgO, берилл и др.) встречаются преимущественно в земной коре и устойчивы к нагреванию.
Объяснение
Когда щелочноземельные металлы (Mg, Ca, Sr, Ba и Ra) реагируют с водой, они образуют гидроксиды, имеющие щелочную (или основную) природу. [2]
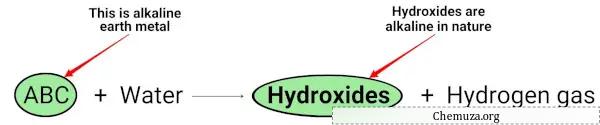
В приведенном выше химическом уравнении вы можете видеть, что щелочные металлы образуют гидроксиды, которые являются основными по своей природе (имеют pH > 7) и выделяют газообразный водород.
Например:
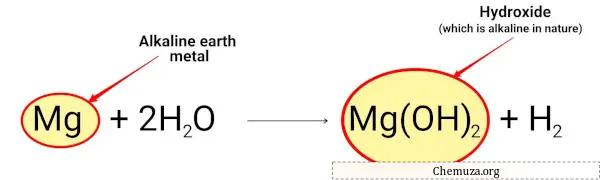
Магний реагирует с водой и образует гидроксид магния, который имеет щелочную природу.
Кроме того, эти металлы встречаются преимущественно в земной коре (в виде оксидов), и эти окисленные минералы термостойки. [2]
Эти два критерия дали этим металлам название «щелочноземельные металлы».
(Примечание: важно отметить, что бериллий, который также является элементом группы 2, не образует щелочной раствор при реакции с водой. Вместо этого его гидроксиды проявляют амфотерное поведение, что означает, что они могут вести себя как кислота или основание. Поэтому бериллий не считается щелочноземельным металлом, хотя и принадлежит к той же группе.)
Что общего у всех щелочноземельных металлов?
Щелочноземельные металлы имеют несколько общих черт.
Например, они оба имеют два валентных электрона на крайнем энергетическом уровне, что делает их весьма реакционноспособными.
Эта реакционная способность обусловлена тенденцией терять эти электроны во время химических реакций, что приводит к образованию катионов с зарядом +2.
Кроме того, все щелочноземельные металлы имеют блестящий серебристо-белый вид.

Итак, это две основные черты, которые объединяет щелочноземельные металлы.
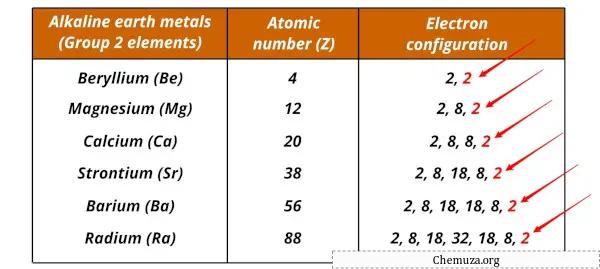
Список щелочных металлов и их электронные конфигурации
Щелочноземельные металлы и их электронные конфигурации показаны ниже.
| Элемент | Электронная конфигурация |
| Бериллий (Be) | [Он] 2с 2 |
| Магний (Мг) | [Делать] 3с 2 |
| Кальций (Ca) | [Ар] 4с 2 |
| Стронций (старший) | [Кр] 5с 2 |
| Барий (Ва) | [Хе] 6с 2 |
| Радий (Ра) | [Рн] 7с 2 |
Периодические тенденции изменения щелочноземельных металлов
При движении вниз по группе щелочноземельных металлов таблицы Менделеева можно наблюдать следующие тенденции:
- Валентность: Все щелочноземельные металлы имеют одинаковую валентность +2. Таким образом, при движении вниз по группе валентность не меняется.
- Атомный размер: атомный размер щелочноземельных металлов увеличивается по мере спуска по группе. Это связано с тем, что количество электронных слоев (или орбит ) увеличивается, а эффект экранирования внутренних электронов уменьшает притяжение между ядром и внешними электронами.
- Металлический характер: Металлический характер щелочноземельных металлов увеличивается по мере продвижения вниз по группе. Это связано с тем, что атомы становятся больше и содержат больше электронов, что позволяет им легче терять электроны и образовывать положительные ионы.
- Электроотрицательность: Электроотрицательность щелочноземельных металлов уменьшается по мере спуска по группе. Это происходит потому, что атомы становятся больше и имеют больше электронных оболочек, что затрудняет притяжение к ним электронов.
- Электронное сродство: Электронное сродство щелочноземельных металлов обычно низкое и уменьшается по мере продвижения вниз по группе.
- Энергия ионизации: энергия ионизации щелочноземельных металлов уменьшается по мере спуска по группе. Это связано с тем, что более крупные атомы имеют больше электронных оболочек, а самые внешние электроны находятся дальше от ядра, что облегчает их удаление.
Краткое содержание
Щелочноземельные металлы включают бериллий, магний, кальций, стронций, барий и радий. У них есть два электрона во внешней оболочке, что делает их реакционноспособными, но в меньшей степени, чем щелочные металлы.
Эти металлы при реакции с водой образуют щелочные гидроксиды и содержат термостабильные окисленные минералы. Основными характеристиками, общими для всех щелочноземельных металлов, являются наличие двух валентных электронов, серебристо-белый цвет и блеск, а также образование катионов с зарядом +2.
Валентность остается неизменной при движении вниз по группе, но размер атома и металлический характер увеличиваются, а электроотрицательность, сродство к электрону и энергия ионизации уменьшаются.
