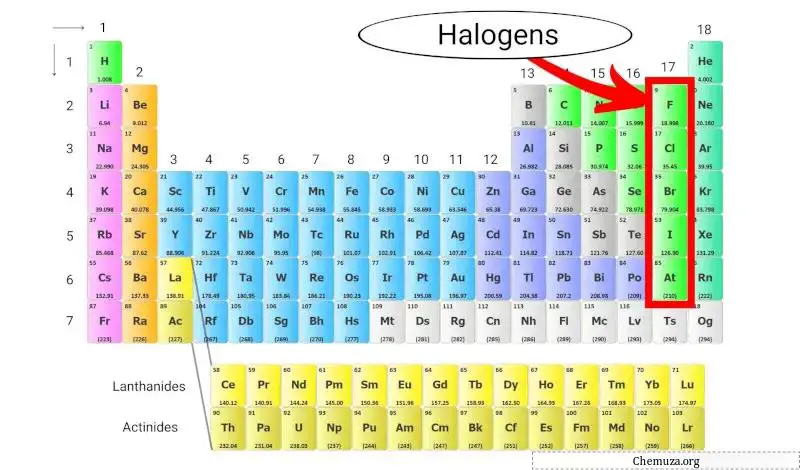
Галогены — это группа элементов, которые входят в 17-ю группу (также называемую группой галогенов) периодической таблицы . Галогены включают пять различных элементов: фтор (F), хлор (Cl), бром (Br), йод (I) и астат (At).
Галогены уникальны, поскольку являются единственной группой элементов, способной образовывать соединения со всеми другими элементами таблицы Менделеева.
Давайте исследуем галогены дальше.
Что такое галогены? И почему их так называют?
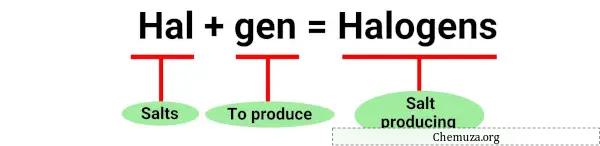
Термин «галоген» происходит от греческих слов «галос», что означает «соль», и «гены», что означает «производитель». [1]
Действительно, галогены были впервые обнаружены благодаря их способности образовывать соли при реакции с металлами .
Например:
Когда хлор (Cl 2 ) реагирует с натрием (Na), образуется хлорид натрия (NaCl), который представляет собой обычную поваренную соль:
2Na + Cl2 → 2NaCl
Аналогично, когда бром (Br 2 ) реагирует с калием (K), образуется бромид калия (KBr):
2К + Бр2 → 2КБр
Эти реакции являются примерами образования солей галогенов при взаимодействии с металлами, отсюда и название «галоген».
Самый активный галоген в таблице Менделеева.
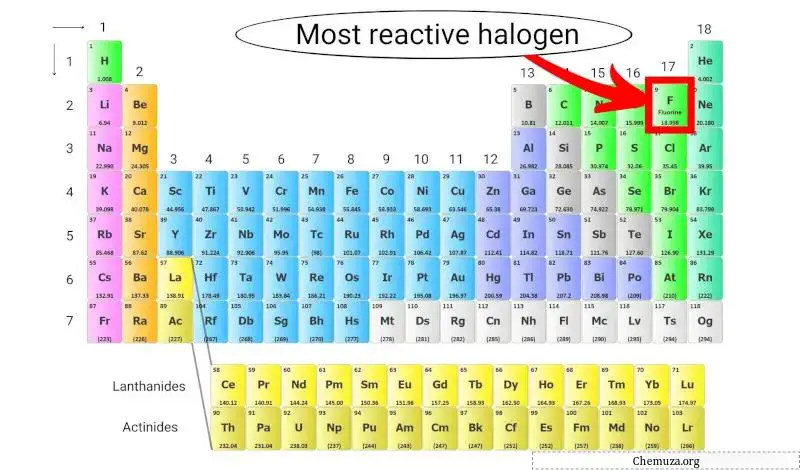
Фтор является наиболее реакционноспособным галогеном, поскольку он имеет самую высокую электроотрицательность среди всех элементов таблицы Менделеева, а это означает, что он обладает сильным притяжением к электронам.
Это делает его очень реакционноспособным и способным реагировать практически с любым другим элементом таблицы Менделеева с образованием соединений. [2]
Проще говоря, фтор подобен магниту для электронов, и он сделает все возможное, чтобы заполучить электрон и завершить свою внешнюю оболочку.
Он делает это, реагируя с другими элементами и крадя их электроны, образуя новые соединения.
Вот почему фтор настолько реактивен и почему он никогда не встречается в природе в своей элементарной форме, а всегда существует в виде соединения.
Из-за своей высокой реакционной способности фторид также чрезвычайно опасен и может быть небезопасен в использовании.
Его часто обрабатывают в специализированных лабораториях и используют в промышленных процессах для производства широкого спектра химикатов и материалов.
Реакционная способность галогенов
Галогены очень реакционноспособны из-за их более высокой электроотрицательности, что означает, что они обладают очень высокой способностью притягивать электроны.
Кроме того, галогены имеют 7 электронов во внешней оболочке, и им нужен только один дополнительный электрон, чтобы заполнить ее и достичь стабильной электронной конфигурации, как у благородных газов .
Например, вы можете видеть, что диаграмма Бора для фтора имеет 7 электронов на внешней оболочке.
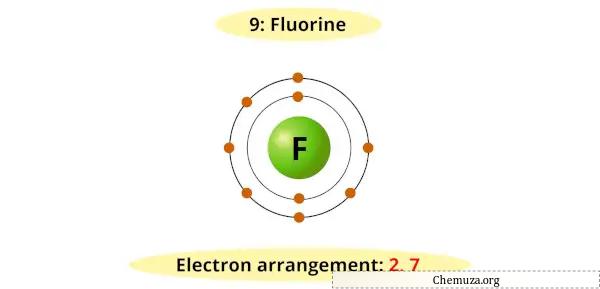
Теперь для получения стабильного октета (7 + 1 = 8) требуется 1 дополнительный электрон.
Галогены реагируют с металлами с образованием ионных соединений, называемых галогенидами металлов , которые могут создавать яркое, красочное пламя.
Они также реагируют с неметаллами, такими как водород , сера и азот , образуя ряд ковалентных соединений. [3]
Следовательно, склонность галогенов присоединять электрон и приобретать стабильную конфигурацию благородного газа делает их очень реакционноспособными и способными образовывать соединения с другими элементами.
Периодические галогенные тенденции
По мере продвижения вниз по группе галогенные элементы демонстрируют изменения как в своих физических, так и в химических свойствах.
Давайте посмотрим на тенденции изменения некоторых свойств галогенов.
- Атомный размер. По мере того, как мы спускаемся по группе, размер атома галогенов увеличивается. Это связано с тем, что каждый галоген имеет на один энергетический уровень больше, чем тот, который находится над ним, а это означает, что самые внешние электроны находятся дальше от ядра.
- Электроотрицательность: по мере продвижения вниз по группе электроотрицательность галогенных элементов уменьшается. Это означает, что галогены в верхней части группы, такие как фтор и хлор, более электроотрицательны и, следовательно, с большей вероятностью притягивают электроны, чем галогены в нижней части группы, такие как йод и астат.
- Точки плавления и точки кипения. По мере продвижения вниз по группе температуры плавления и кипения галогенов увеличиваются. Действительно, более крупные атомы имеют больше электронов и способны образовывать более сильные межмолекулярные силы. [4]
- Реакционная способность по отношению к металлам. По мере движения вниз по группе реакционная способность галогенов по отношению к металлам снижается. Это означает, что галогены в верхней части группы, такие как фтор и хлор, с большей вероятностью вступят в реакцию с металлами, чем галогены в нижней части группы, такие как йод и астат.
Краткое содержание
Галогены — это группа из пяти элементов (фтор, хлор, бром, йод и астат), находящихся в 17-й группе периодической таблицы. Они уникальны своей способностью образовывать соединения со всеми другими элементами.
Галогены очень реакционноспособны из-за их высокой электроотрицательности и склонности присоединять электрон для достижения стабильной конфигурации благородного газа. Фтор является наиболее реакционноспособным галогеном из-за его высокой электроотрицательности.
По мере продвижения вниз по группе галогены демонстрируют изменения в своих физических и химических свойствах, такие как увеличение размера атома, уменьшение электроотрицательности и увеличение температур плавления и кипения. Реакционная способность галогенов по отношению к металлам также снижается по мере движения вниз по группе.
