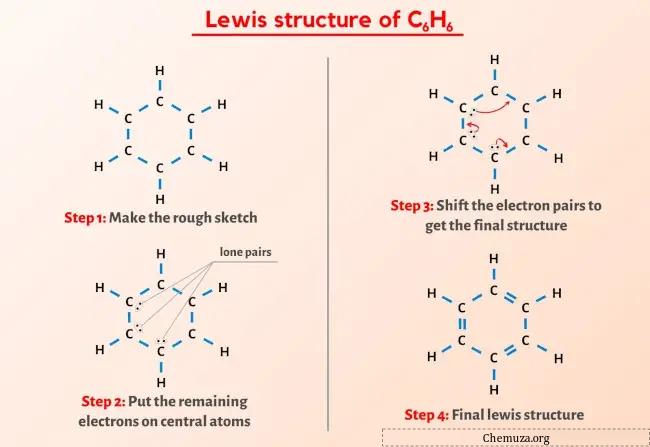
Итак, вы уже видели изображение выше, верно?
Позвольте мне кратко объяснить изображение выше.
Структура Льюиса C6H6 (бензол) имеет 6 атомов углерода (C) в кольцевой структуре, и каждый атом углерода присоединен к 1 атому водорода (H). В кольцевой структуре углерода (С) имеются чередующиеся двойные связи.
Если вы ничего не поняли из приведенного выше изображения структуры Льюиса C6H6, оставайтесь со мной, и вы получите подробное пошаговое объяснение того, как нарисовать структуру Льюиса C6H6 .
Итак, перейдем к этапам рисования структуры Льюиса C6H6 (бензола).
Шаги по рисованию структуры Льюиса C6H6
Шаг 1: Найдите общее количество валентных электронов в молекуле C6H6.
Чтобы найти общее количество валентных электронов в молекуле C6H6, сначала необходимо знать, сколько валентных электронов присутствует в атоме углерода , а также в атоме водорода.
(Валентные электроны — это электроны, находящиеся на самой внешней орбите любого атома.)
Здесь я расскажу вам, как легко найти валентные электроны углерода, а также водорода с помощью таблицы Менделеева.
Сумма валентных электронов в молекуле C6H6
→ Валентные электроны, отдаваемые атомом углерода:
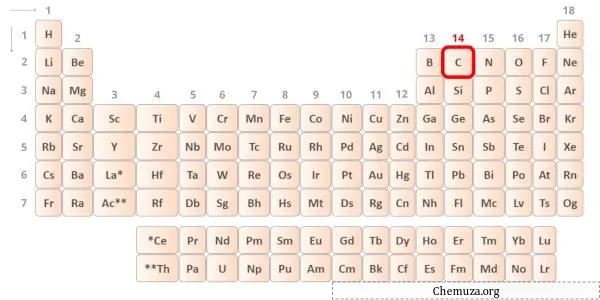
Углерод — элемент 14-й группы таблицы Менделеева. [1] Следовательно, валентные электроны, присутствующие в углероде, равны 4 .
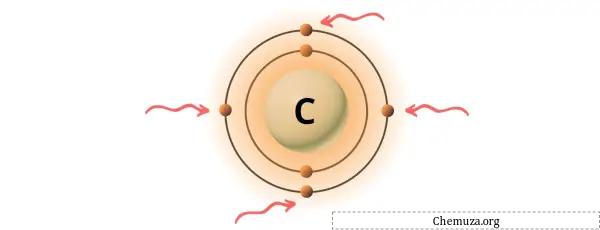
Вы можете увидеть 4 валентных электрона, присутствующих в атоме углерода, как показано на изображении выше.
→ Валентные электроны, отдаваемые атомом водорода:
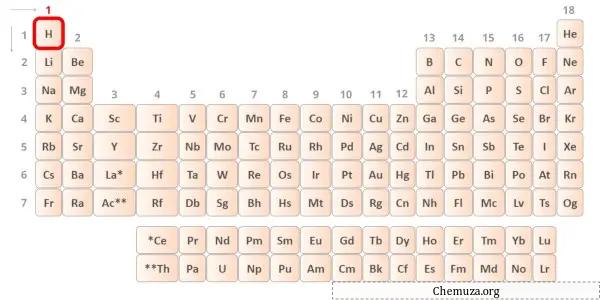
Водород — элемент 1 группы таблицы Менделеева. [2] Следовательно, валентный электрон, присутствующий в водороде, равен 1 .

Вы можете видеть, что в атоме водорода присутствует только один валентный электрон, как показано на изображении выше.
Так,
Общее количество валентных электронов в молекуле C6H6 = валентные электроны, подаренные 6 атомами углерода + валентные электроны, подаренные 6 атомами водорода = 4(6) + 1(6) = 30 .
Шаг 2: Подготовьте эскиз
Структура Льюиса бензола (C6H6) имеет 6 атомов углерода, расположенных в кольцевую структуру.
Кроме того, каждый из этих атомов углерода связан с 1 атомом водорода.
Итак, давайте нарисуем эскиз, который представляет собой кольцо из 6 атомов углерода и атомов водорода, прикрепленных к каждому углероду.
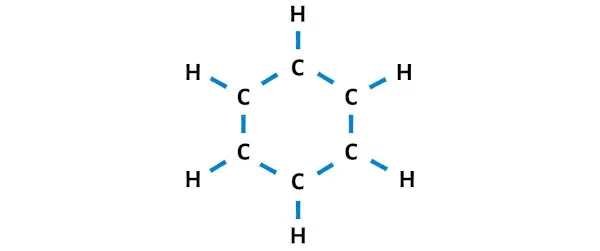
На рисунке выше 12 одинарных связей. Таким образом, из 30 валентных электронов на приведенной выше диаграмме используются 24 валентных электрона .
Шаг 3: Оставьте оставшиеся электроны на центральном атоме
Как видите, на шаге 1 мы рассчитали общее количество валентных электронов, присутствующих в молекуле C6H6.
Молекула C6H6 имеет всего 30 валентных электронов , из них на диаграмме выше используются только 24 валентных электрона .
Таким образом, количество оставшихся электронов = 30 – 24 = 6 .
Вам нужно разместить эти 6 электронов (то есть 3 электронные пары ) на атомах углерода на приведенной выше схеме молекулы C6H6.
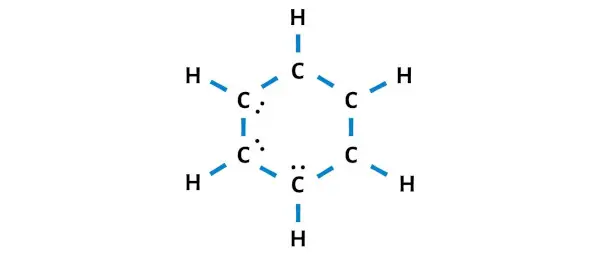
Теперь перейдем к следующему шагу.
Шаг 4: Сделайте все атомы стабильными
На рисунке выше вы можете видеть, что внешние атомы водорода образуют дуплет . Поэтому они стабильны.
Теперь из шести атомов углерода три атома углерода не образуют октет .
Поэтому нам нужно переместить электронные пары таким образом, чтобы весь углерод образовал октет и стал стабильным.
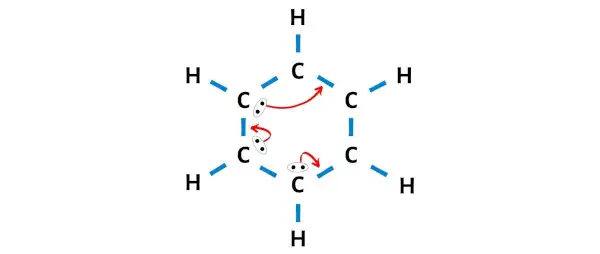
После перемещения электронных пар вы можете увидеть, что 6 атомов углерода образуют октет и теперь стабильны.
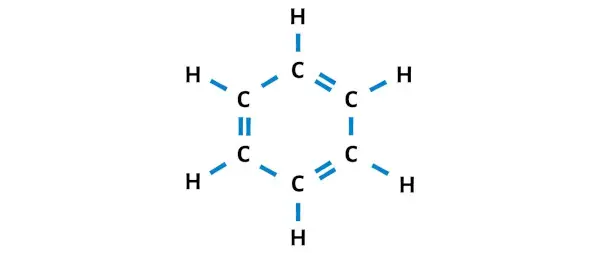
Таким образом, это стабильная структура Льюиса бензола (или C6H6).
Надеюсь, вы полностью поняли все шаги, описанные выше.
Для большей практики и лучшего понимания вы можете попробовать другие структуры Льюиса, перечисленные ниже.
Попробуйте (или хотя бы посмотрите) эти структуры Льюиса для лучшего понимания:
