Йодид меди (CuI) представляет собой ярко-желтое химическое соединение. Он образуется при реакции меди с йодом и используется в различных приложениях, включая органический синтез и катализ.
| Название ИЮПАК | Йодид меди(I) |
| Молекулярная формула | CuI |
| Количество CAS | 7681-65-4 |
| Синонимы | Йодид меди, монойодид меди, йодид меди (1:1) |
| ИнЧИ | InChI=1S/Cu.HI/h;1H/q+1;/p-1 |
Свойства йодида меди
Формула йодида меди
Химическая формула йодида меди — CuI. Это указывает на то, что каждая единица йодида меди состоит из одного атома меди (Cu) и одного атома йода (I). Эта простая формула отражает стехиометрию соединения.
Иодид меди Молярная масса
Молярную массу йодида меди (CuI) можно рассчитать путем сложения атомных масс составляющих его элементов. Медь имеет молярную массу примерно 63,55 г/моль, а молярная масса йода составляет примерно 126,90 г/моль. Таким образом, молярная масса CuI составляет примерно 190,45 г/моль.
Температура кипения йодида меди
Йодид меди не имеет четко определенной температуры кипения, поскольку он подвергается разложению до достижения точки кипения. При нагревании он разлагается на металлическую медь и газообразный йод, что делает его непригодным для традиционного определения температуры кипения.
Температура плавления йодида меди
Температура плавления йодида меди относительно низкая по сравнению со многими другими галогенидами металлов. Его температура плавления составляет около 606 градусов по Цельсию (1123 градуса по Фаренгейту). При этой температуре твердый йодид меди превращается в расплавленную жидкость.
Плотность йодида меди г/мл
Йодид меди имеет плотность примерно 5,67 г/мл. Это значение представляет собой массу йодида меди на единицу объема. Это указывает на то, что йодид меди относительно плотный по сравнению с некоторыми другими неорганическими соединениями.
Иодид меди Молекулярный вес
Молекулярная масса йодида меди, также называемая молярной массой, составляет примерно 190,45 г/моль. Это сумма атомных весов всех атомов, присутствующих в молекуле йодида меди (CuI).
Структура йодида меди
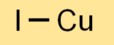
Йодид меди существует в различных кристаллических структурах, включая альфа-, бета- и гамма-фазы. Наиболее распространенной формой является альфа-фаза, имеющая структуру смеси цинка. Он образует сеть атомов меди и йода.
Растворимость йодида меди
Растворимость иодида меди в разных растворителях неодинакова. Он плохо растворяется в воде, и его растворимость можно повысить добавлением йодид-ионов. Органические растворители, такие как этанол, растворяют его более эффективно, чем вода.
| Появление | Ярко-желтое твердое вещество |
| Удельный вес | 5,67 г/мл |
| Цвет | ЖЕЛТЫЙ |
| Запах | Без запаха |
| Молярная масса | 190,45 г/моль |
| Плотность | 5,67 г/см³ |
| Точка плавления | 606°С (1123°Ф) |
| Точка кипения | Разлагается перед кипячением |
| Мигающая точка | Непригодный |
| Растворимость в воде | Плохо растворим |
| Растворимость | Растворим в органических растворителях, таких как этанол и эфир. |
| Давление газа | Нет в наличии |
| Плотность пара | Нет в наличии |
| пКа | Нет в наличии |
| рН | Непригодный |
Обратите внимание, что некоторые свойства, такие как температура вспышки, давление пара, плотность пара, pKa и pH, неприменимы или недоступны для йодида меди из-за его природы и свойств.
Безопасность и опасность йодида меди
Йодид меди представляет определенные риски для безопасности, которые необходимо учитывать при обращении. Очень важно носить соответствующие средства индивидуальной защиты (СИЗ), такие как перчатки и очки, чтобы избежать контакта с кожей и глазами. Следует избегать вдыхания пыли или паров, поскольку это может вызвать раздражение дыхательных путей. Йодид меди умеренно токсичен при проглатывании, поэтому его нельзя употреблять. Кроме того, важно работать с йодидом меди в хорошо проветриваемом помещении, чтобы избежать накопления паров. Правильное хранение в плотно закрытых контейнерах вдали от несовместимых веществ имеет решающее значение для минимизации потенциальных опасностей.
| Символы опасности | Раздражающий |
| Описание безопасности | Вызывает раздражение кожи и глаз. Умеренно токсичен при проглатывании. Избегайте вдыхания. Используйте в хорошо проветриваемом помещении. Носите соответствующие средства индивидуальной защиты. |
| Идентификационные номера ООН | Непригодный |
| код ТН ВЭД | Непригодный |
| Класс опасности | Непригодный |
| Группа упаковки | Непригодный |
| Токсичность | Умеренно токсичен при проглатывании |
Методы синтеза йодида меди
Йодид меди можно синтезировать разными методами. Обычный метод синтеза йодида меди включает смешивание мелко измельченной меди с йодом и нагревание смеси в контролируемой среде. При повышении температуры Cu реагирует с йодом с образованием йодида меди.
Другой подход заключается в добавлении оксида меди (CuO) или гидроксида меди (Cu(OH)2) к иодоводородной кислоте (HI) и нагревании смеси. Реакция между кислотой и соединением меди приводит к образованию иодида меди.
Йодид меди также можно получить путем смешивания соли меди, такой как CuSO4 , с растворимой солью йодида, такой как йодид калия (KI), в воде. Эта реакция приводит к осаждению иодида меди.
Кроме того, реакция двойного замещения между растворимой солью Cu, такой как сульфат меди, и растворимой йодистой солью, такой как йодид натрия (NaI), в водном растворе дает твердый йодид меди в виде осадка. .
Эти методы синтеза открывают различные пути получения йодида меди, что позволяет использовать его в широком спектре приложений в химии и промышленности.
Применение йодида меди
Йодид меди находит универсальное применение в различных областях благодаря своим уникальным свойствам. Вот некоторые из его основных применений:
- Органический синтез: Йодид меди служит катализатором в органических реакциях, способствуя различным реакциям сочетания, таким как реакции Ульмана, Соногаширы и Глейзера.
- Полупроводники: используется при производстве полупроводников, особенно как полупроводниковый материал P-типа.
- Фотоэлектрические устройства: Йодид меди используется в солнечных элементах и фотодетекторах из-за его свойств фотопроводимости и светопоглощения.
- Гальваника: используется в качестве электролитической добавки в гальванических ваннах для улучшения осаждения меди.
- Пигменты: Ярко-желтый цвет йодида меди делает его ценным пигментом в керамической и стекольной промышленности.
- Противообрастающая краска: Это важный компонент противообрастающих красок для морского применения.
- Химические реагенты: Йодид меди используется в лабораториях в качестве химического реагента для различных тестов и экспериментов.
- Рентгеноконтрастные вещества. В медицинской визуализации для рентгеновских исследований используются контрастные вещества на основе йодистой меди.
- Консервант для древесины: йодид меди защищает древесину от гниения и заражения насекомыми, что делает ее полезной в лесной промышленности.
- Фунгициды: действует как эффективный фунгицид, защищая сельскохозяйственные культуры и растения от грибковых инфекций.
Многочисленные применения йодида меди демонстрируют его важность во многих отраслях промышленности, от электроники и фотоэлектрической техники до сельского хозяйства и медицины.
Вопросы:
Вопрос: Как сделать йодид меди?
A: Йодид меди можно синтезировать путем реакции металлической меди или оксида меди с йодом или реакциями двойного замещения с использованием сульфата меди и йодида калия.
Вопрос: Растворяется ли йодид меди в воде?
Ответ: Нет, йодид меди (CuI2) нерастворим в воде.
Вопрос: Каково молекулярное уравнение реакции нитрата меди II и йодида калия?
A: Молекулярное уравнение: Cu(NO3)2 + 2KI → CuI2 + 2KNO3.
Вопрос: Какова формула йодида меди?
Ответ: Формула йодида меди: CuI2.
Вопрос: Является ли йодид меди(II) нерастворимым?
Ответ: Да, йодид меди(II) (CuI2) нерастворим в воде.
Вопрос: Безопасно ли смешивать сульфат меди и йодид калия?
Ответ: При смешивании CaSO4 и йодида калия может образоваться йодид меди, но необходимо соблюдать осторожность из-за реакционной способности используемых химических веществ.
Вопрос: Как называется соединение формулы CUI2?
A: Соединение формулы CUI2 представляет собой йодид меди (II).
Вопрос: Является ли CUI2 осадком?
Ответ: Да, CUI2 может образовывать осадок в некоторых реакциях из-за его низкой растворимости в воде.
Вопрос: Растворим ли CUI2 в воде?
О: Нет, CUI2 не растворяется в воде.
Вопрос: Разрешим ли CUI2?
О: Нет, CUI2 не растворяется в большинстве распространенных растворителей.
Вопрос: Что делает CUI2 неразрешимым?
Ответ: Низкая растворимость CUI2 обусловлена его сильной ионной связью между медью и йодом, что приводит к ограниченной диссоциации в воде.
