Карбонат меди (CuCO3) представляет собой соединение сине-зеленого цвета, образующееся естественным путем в результате реакции солей меди с ионами карбоната. Он имеет различные промышленные применения, включая пигменты и фунгициды.
| Название ИЮПАК | Карбонат меди(II) |
| Молекулярная формула | CuCO3 |
| Количество CAS | 1184-64-1 |
| Синонимы | Основной карбонат меди, карбонат меди, монокарбонат меди |
| ИнЧИ | InChI=1S/CH2O3.Cu/c2-1(3)4;/h(H2,2,3,4);/q;+2/p-2 |
Свойства карбоната меди
Формула карбоната меди
Химическая формула карбоната меди: CuCO3. Он представляет собой комбинацию одного атома меди (Cu), одного атома углерода (С) и трех атомов кислорода (О). Эта формула предоставляет важную информацию об элементном составе соединения.
Карбонат меди Молярная масса
Карбонат меди имеет молярную массу примерно 123,55 грамма на моль (г/моль). Молярная масса представляет собой сумму атомных масс всех атомов, присутствующих в моле вещества, и выражается в граммах на моль.
Температура кипения карбоната меди
Карбонат меди не имеет четкой точки кипения, поскольку при нагревании примерно до 200°C он разлагается на CuO и углекислый газ. Поэтому он подвергается термическому разложению, а не кипению.
Карбонат меди. Температура плавления.
Карбонат меди имеет температуру плавления около 200°C (392°F). При этой температуре твердый карбонат меди переходит в жидкое состояние. Однако следует отметить, что он разлагается, не достигнув точки кипения.
Плотность карбоната меди г/мл
Плотность карбоната меди составляет примерно 3,6 грамма на миллилитр (г/мл). Плотность измеряет массу вещества на единицу объема и указывает, насколько плотно упакованы вместе его частицы.
Молекулярный вес карбоната меди
Молекулярная масса карбоната меди, также называемая молярной массой, составляет примерно 123,55 г/моль. Это значение имеет решающее значение для различных химических расчетов и преобразований.
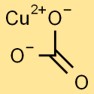
Структура карбоната меди
Карбонат меди имеет тригональную плоскую структуру. Центральный атом меди окружен тремя атомами кислорода и карбонатной группой, состоящей из одного атома углерода и трех атомов кислорода, связанных вместе.
Растворимость карбоната меди
Карбонат меди плохо растворяется в воде, а это означает, что он растворяется лишь в ограниченной степени. На растворимость влияют такие факторы, как температура и pH. Он реагирует с кислотами с образованием солей меди и выделением углекислого газа.
| Появление | Сине-зеленое твердое вещество |
| Удельный вес | ~3,6 г/мл |
| Цвет | Цвет морской волны |
| Запах | Без запаха |
| Молярная масса | ~123,55 г/моль |
| Плотность | ~3,6 г/мл |
| Точка плавления | ~200°С (392°Ф) |
| Точка кипения | Разлагается при ~200°C |
| Мигающая точка | Непригодный |
| Растворимость в воде | Плохо растворим, зависит от температуры и pH. |
| Растворимость | Нерастворим в большинстве растворителей. |
| Давление газа | Непригодный |
| Плотность пара | Непригодный |
| пКа | Непригодный |
| рН | Щелочная (основная) |
Безопасность и опасность карбоната меди
Карбонат меди представляет определенные соображения безопасности и опасности. Крайне важно обращаться с ним осторожно, чтобы избежать потенциальных рисков. Прямой контакт с кожей, глазами или вдыхание пыли может вызвать раздражение и дискомфорт. Длительное воздействие или проглатывание могут быть вредными и привести к более серьезным проблемам со здоровьем. При нагревании он может выделять токсичные пары, в том числе углекислый газ, что требует соответствующей вентиляции. Кроме того, карбонат меди легко воспламеняется в виде порошка, поэтому требует осторожного хранения и обращения во избежание опасности возгорания. Для обеспечения безопасности всегда соблюдайте меры предосторожности, носите соответствующие средства защиты и храните составы вдали от несовместимых материалов.
| Символы опасности | Раздражающе, Опасно |
| Описание безопасности | Обращаться осторожно. Избегайте прямого контакта. Используйте в хорошо вентилируемых помещениях. Соблюдайте инструкции по технике безопасности и носите защитное снаряжение. |
| Идентификационные номера ООН | Не атрибутировано |
| код ТН ВЭД | 2836.40.0000 |
| Класс опасности | Неклассифицированный |
| Группа упаковки | Непригодный |
| Токсичность | Низкая токсичность; может вызвать раздражение и дискомфорт при контакте; избегать проглатывания и вдыхания. |
Методы синтеза карбоната меди
Существуют различные методы синтеза карбоната меди, все из которых включают сочетание солей меди с источниками карбоната. Распространенным подходом является взаимодействие CuSO4 с карбонатом натрия (Na2CO3) в водном растворе. В результате этой реакции выпадает осадок карбоната меди, его отделяют фильтрованием с последующей сушкой с получением твердого продукта.
Другой метод предполагает реакцию CuCl2 с карбонатом или бикарбонатом натрия (NaHCO3) в аналогичной водной среде. В результате этой реакции в качестве побочного продукта образуется карбонат меди и хлорид натрия (NaCl).
Кроме того, барботирование диоксида углерода (CO2) через раствор Cu(OH)2 приводит к образованию осадка карбоната меди при конверсии гидроксида.
Металл Cu взаимодействует с углекислым газом в контролируемой среде с образованием карбоната меди.
Контроль условий реакции, таких как температура и концентрация, становится решающим для достижения желаемых выходов и чистоты. Эти методы позволяют производить карбонат меди для различных промышленных применений, включая его использование в качестве пигмента, фунгицида или в других химических процессах.
Использование карбоната меди
Карбонат меди благодаря своим уникальным свойствам находит универсальное применение в различных отраслях промышленности. Вот некоторые ключевые области применения карбоната меди:
- Пигменты: карбонат меди широко придает яркие сине-зеленые оттенки краскам, керамике и пластмассам, улучшая их внешний вид.
- Сельскохозяйственный фунгицид: он эффективно служит фунгицидом в сельском хозяйстве, защищая посевы от грибковых инфекций и способствуя здоровому росту растений.
- Консервация древесины: Карбонат меди используется в составах консервантов для древесины, защищая древесину от гниения и повреждения насекомыми.
- Гальваника: существенно облегчает процессы гальваники, позволяя наносить медное покрытие на различные металлические поверхности, тем самым улучшая проводимость и коррозионную стойкость.
- Катализатор: Карбонат меди действует как активный катализатор в нескольких химических реакциях, ускоряя скорость реакции, не претерпевая при этом существенных изменений.
- Альгицид: при очистке воды он активно действует как альгицид, контролируя рост водорослей в резервуарах, прудах и водных системах.
- Производство стекла: Карбонат меди активно участвует в производстве изделий из стекла с зеленым тонированием, таких как бутылки и декоративная стеклянная посуда, в стекольной промышленности.
- Искусственные ювелирные изделия: при производстве искусственных ювелирных изделий активно используется карбонат меди, что обеспечивает доступную альтернативу настоящим ювелирным изделиям на основе меди.
- Аналитическая химия: карбонат меди находит активное применение в качестве реагента в аналитической химии для проведения различных опытов и экспериментов.
- Фейерверки и пиротехника: активно способствует ярко-зеленому цвету фейерверков и пиротехнических шоу.
Разнообразие применений подчеркивает важность карбоната меди как ценного химического соединения во многих отраслях промышленности, улучшающего как продукты, так и процессы.
Вопросы:
Вопрос: Сколько молей атомов кислорода содержится в 5,67 молях карбоната меди(II)?
А: В 5,67 молях карбоната меди(II) содержится 17,01 моля атомов кислорода (3 атома кислорода на 1 моль CuCO3).
Вопрос: Растворим ли карбонат меди?
Ответ: Карбонат меди плохо растворяется в воде.
Вопрос: Какой элемент с большей вероятностью пропускает электричество: медь, углерод, гелий или сера?
Ответ: Медь — это элемент, который с наибольшей вероятностью проводит электричество, поскольку он является хорошим проводником электричества.
Вопрос: Как сделать карбонат меди?
Ответ: Карбонат меди можно получить путем взаимодействия солей меди с источниками карбонатов, такими как карбонат натрия, или путем барботирования диоксида углерода через раствор Cu(OH)2.
Вопрос: Как использовать карбонат меди в гончарном деле?
Ответ: Карбонат меди используется в гончарном деле в качестве керамической глазури для придания сине-зеленого цвета готовым изделиям.
Вопрос: Растворим ли CuCO3 в воде?
Ответ: CuCO3 плохо растворяется в воде.
Вопрос: Как можно использовать реакцию осаждения для подготовки образца CuCO3?
Ответ: Чтобы получить CuCO3 реакцией осаждения, вы можете смешать растворимую соль меди с растворимой карбонатной солью, что приведет к образованию нерастворимого карбоната меди, который можно отделить фильтрацией.
Вопрос: Как называется соединение CuCO3?
Ответ: Соединение CuCO3 называется карбонатом меди(II).
Вопрос: Какова молярная масса CuCO3?
A: Молярная масса CuCO3 составляет примерно 123,55 г/моль.
Вопрос: CuCO3 растворим или нерастворим?
Ответ: CuCO3 нерастворим в большинстве растворителей, включая воду.
Вопрос: Из чего состоит карбонат меди(II)?
Ответ: Карбонат меди(II) состоит из одного атома меди, одного атома углерода (С) и трёх атомов кислорода (О).
