Хлорид цинка (ZnCl2) представляет собой белое кристаллическое соединение. Он используется в различных промышленных применениях, таких как флюсы для пайки, химический синтез и гальванизация. Он очень растворим в воде.
| Название ИЮПАК | Хлорид цинка |
| Молекулярная формула | ZnCl2 |
| Количество CAS | 7646-85-7 |
| Синонимы | цинковое масло; цинка дихлорид; хлорид цинка(II); цинковое масло; CI77043 |
| ИнЧИ | InChI=1S/2ClH.Zn/h2*1H;/q;;+2/p-2 |
Свойства хлорида цинка
Формула хлорида цинка
Химическая формула дихлорида цинка: ZnCl2. Он состоит из одного атома цинка (Zn) и двух атомов хлора (Cl). Это ионное соединение образует белое кристаллическое твердое вещество с четко выраженной структурой.
хлорид цинка Молярная масса
Молярная масса дихлорида цинка составляет приблизительно 136,29 грамма на моль (г/моль). Он получается из суммы атомных масс одного атома цинка и двух атомов хлора.
Температура кипения хлорида цинка
Дихлорид цинка имеет относительно высокую температуру кипения — около 732 градусов Цельсия (C) или 1350 градусов по Фаренгейту (F). При этой температуре он переходит из жидкого состояния в газообразное.
Температура плавления хлорида цинка
Температура плавления дихлорида цинка составляет примерно 290 градусов по Цельсию (C) или 554 градуса по Фаренгейту (F). При этой температуре твердый дихлорид цинка переходит в жидкое состояние.
Плотность хлорида цинка г/мл
Плотность дихлорида цинка составляет примерно 2,91 грамма на миллилитр (г/мл) при комнатной температуре. Это свойство описывает его массу в единице объема.
Хлорид цинка Молекулярный вес
Молекулярная масса дихлорида цинка, рассчитанная по его химической формуле, составляет примерно 136,29 г/моль. Это значение представляет собой сумму атомных весов составляющих его атомов.
Структура хлорида цинка
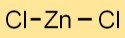
Дихлорид цинка имеет структуру кристаллической решетки, в которой катионы Zn2+ и кланионы удерживаются вместе ионными связями. Расположение образует стабильную и упорядоченную трехмерную сеть.
Растворимость хлорида цинка
Дихлорид цинка хорошо растворим в воде, то есть легко растворяется в присутствии молекул воды. Это свойство способствует его широкому использованию в различных отраслях промышленности и химических процессах.
| Появление | Белое кристаллическое твердое вещество |
| Удельный вес | 2,91 г/мл |
| Цвет | Бесцветный |
| Запах | Без запаха |
| Молярная масса | 136,29 г/моль |
| Плотность | 2,91 г/см³ |
| Точка плавления | 290°С (554°Ф) |
| Точка кипения | 732°С (1350°Ф) |
| Мигающая точка | Непригодный |
| Растворимость в воде | Очень растворим в воде |
| Растворимость | Растворим в органических растворителях, таких как спирт и ацетон. |
| Давление газа | 1 мм рт.ст. при 359°C |
| Плотность пара | 5,4 (воздух = 1) |
| пКа | -1,9 |
| рН | ~5 (0,1 М раствор в воде) |
Безопасность и опасность хлорида цинка
Дихлорид цинка представляет определенную угрозу безопасности, требующую осторожного обращения. Прямой контакт с кожей или глазами может вызвать раздражение и ожоги. Вдыхание его паров может вызвать раздражение дыхательной системы. При работе с составом важно носить защитное оборудование, такое как перчатки и очки. Кроме того, его следует хранить в хорошо проветриваемом помещении, вдали от несовместимых веществ. В случае проглатывания или случайного воздействия немедленно обратитесь за медицинской помощью. Избегайте попадания его в окружающую среду, так как это может быть вредно для водной флоры и фауны. Соблюдая надлежащие меры безопасности и рекомендации, можно эффективно свести к минимуму риски, связанные с дихлоридом цинка.
| Символы опасности | Коррозионный (С); Вредный (Xn) |
| Описание безопасности | Избегайте контакта с кожей и глазами. Используйте в хорошо проветриваемом помещении. Наденьте перчатки и защитные очки. В случае контакта или проглатывания обратитесь к врачу. Не выпускать в окружающую среду. Беречь от несовместимых веществ. |
| Идентификационные номера ООН | № ООН 2331 (Цинка дихлорид безводный); № ООН 2332 (Цинка дихлорид, раствор) |
| код ТН ВЭД | 28273990 |
| Класс опасности | 8 (Коррозионные вещества) |
| Группа упаковки | II (Средняя опасность) |
| Токсичность | Вреден при проглатывании или вдыхании. |
Методы синтеза хлорида цинка
Различные методы позволяют синтезировать дихлорид цинка.
Распространенный подход включает реакцию оксида цинка (ZnO) с соляной кислотой (HCl) . В этом методе химик медленно добавляет ZnO в раствор HCl, постоянно помешивая. В результате реакции в качестве побочных продуктов образуются дихлорид цинка и вода. Другой метод — напрямую соединить металлический цинк с газообразным хлором (Cl2). Эта реакция требует тщательного контроля температуры и давления для обеспечения успешного результата.
Альтернативный процесс включает растворение металлического цинка в растворе HCl, что приводит к образованию дихлорида цинка и газообразного водорода (H2). Обработка HCl карбонатом цинка (ZnCO3) или гидроксидом цинка (Zn(OH)2) приводит к образованию дихлорида цинка, воды и диоксида углерода (CO2) в качестве побочных продуктов.
Сульфат цинка (ZnSO4) и хлорид бария (BaCl2) подвергаются реакции двойного разложения с образованием дихлорида цинка, а также с образованием сульфата бария (BaSO4). При смешивании этих двух соединений дихлорид цинка выпадает в осадок, а сульфат бария (BaSO4) остается в растворе.
Каждый из этих методов обеспечивает путь синтеза дихлорида цинка, и выбор метода зависит от таких факторов, как доступность реагентов, условия реакции и желаемая чистота конечного продукта.
Использование хлорида цинка
Дихлорид цинка находит широкое применение в различных отраслях промышленности благодаря своим универсальным свойствам. Вот некоторые важные области применения дихлорида цинка:
- Гальванизация: дихлорид цинка играет важную роль в процессе гальванизации, предотвращая коррозию таких металлов, как сталь и железо. Образует защитное цинковое покрытие, повышающее их долговечность и долговечность.
- Паяльный флюс: при пайке дихлорид цинка действует как флюс, удаляющий оксиды металлов с поверхности металлов, обеспечивая лучшую адгезию и прочную связь между припоем и металлом.
- Химический синтез: служит катализатором или реагентом во многих химических реакциях, таких как ацилирование и дегидратация Фриделя-Крафтса.
- Консервация древесины: в средствах для консервации древесины используется дихлорид цинка для защиты древесины от грибковой гнили и насекомых, продлевая ее срок службы.
- Обработка текстиля: в текстильной промышленности он облегчает производство мерсеризованных хлопчатобумажных тканей, придающих желаемые свойства, такие как повышенный блеск и повышенная прочность.
- Электролит батареи: дихлорид цинка действует как электролит в некоторых батареях, таких как углеродно-цинковые батареи, помогая облегчить поток ионов между электродами.
- Дезодорант и антиперспирант: это распространенный ингредиент антиперспирантов из-за его вяжущих свойств, которые помогают уменьшить выработку пота и контролировать запах тела.
- Фармацевтика: Дихлорид цинка находит применение в различных фармацевтических составах, особенно в средствах для полоскания рта, пастилках для горла и антисептических растворах для местного применения.
- Красильная промышленность: Красильная промышленность использует дихлорид цинка в качестве протравы в процессе крашения, чтобы улучшить стойкость цвета тканей с красителями.
- Составы клеев. Производители включают дихлорид цинка в составы клеев для улучшения связующих свойств клеев и цементов.
Универсальность дихлорида цинка делает его незаменимым соединением во многих промышленных процессах и повседневных продуктах, способствуя развитию нескольких ключевых отраслей промышленности.
Вопросы:
Вопрос: Растворим ли ZnCl2 в воде?
Ответ: Да, ZnCl2 хорошо растворяется в воде.
Вопрос: Каково чистое ионное уравнение реакции ZnCl2 с NaOH?
A: Чистое ионное уравнение: Zn²⁺(водный раствор) + 2OH⁻(водный раствор) → Zn(OH)₂(тв).
Вопрос: Растворим ли ZnCl2?
О: Да, ZnCl2 растворим в воде.
Вопрос: Является ли ZnCl2 ионным или молекулярным?
Ответ: ZnCl2 — ионное соединение.
Вопрос: Какой тип связи возникает в хлориде цинка (II) ZnCl2?
A: Ионная связь возникает в ZnCl2.
Вопрос: Какое изменение может снизить скорость производства ZnCl2?
Ответ: Снижение температуры реакции может снизить скорость производства ZnCl2.
Вопрос: ZnCl2 твердый?
Ответ: Да, ZnCl2 является твердым веществом при комнатной температуре.
Вопрос: Является ли ZnCl2 солью?
Ответ: Да, ZnCl2 считается солью.
Вопрос: Как получить хлорид цинка из цинка?
Ответ: Реакция цинка с соляной кислотой приводит к образованию хлорида цинка.
Вопрос: Какова формула хлорида цинка?
Ответ: Формула хлорида цинка: ZnCl2.
В: Являются ли хлорид-цинковые батареи вредными для Земли?
О: Да, хлорид-цинковые батареи могут быть вредными для окружающей среды, если их не утилизировать должным образом.
Вопрос: Какова молярная масса хлорида цинка?
A: Молярная масса хлорида цинка составляет приблизительно 136,29 г/моль.
