Нитрат меди (Cu(NO3)2) — кристаллическое соединение синего цвета, используемое в различных отраслях промышленности. Он служит катализатором, окислителем и предшественником медных материалов в химических процессах.
| Название ИЮПАК | Нитрат меди(II) |
| Молекулярная формула | Cu(NO3)2 |
| Количество CAS | 3251-23-8 |
| Синонимы | Нитрат меди; Медная селитра; Медная селитра; Азотная кислота, соль меди (2+) |
| ИнЧИ | InChI=1S/2NO3.Cu/c2 2-1(3)4;/q2 -1;+2 |
Свойства медной селитры
Формула нитрата меди
Химическая формула нитрата меди: Cu(NO3)2. Это указывает на то, что каждая молекула нитрата меди содержит один ион меди (Cu) и два иона нитрата (NO3). Присутствие ионов меди(II) указывает на степень окисления меди +2.
Нитрат меди Молярная масса
Молярную массу нитрата меди можно рассчитать, сложив атомные массы составляющих его элементов. Медь (Cu) имеет молярную массу примерно 63,55 г/моль, а нитрат (NO3) имеет молярную массу примерно 62,00 г/моль. Итак, молярная масса нитрата меди составляет примерно 187,55 г/моль.
Температура кипения нитрата меди
Точка кипения нитрата меди относится к температуре, при которой он переходит из жидкого состояния в газообразное при стандартном атмосферном давлении. Температура кипения нитрата меди обычно превышает 100°C (212°F). Однако важно отметить, что нитрат меди обычно разлагается до достижения точки кипения.
Температура плавления нитрата меди
Точка плавления нитрата меди — это температура, при которой он переходит из твердого состояния в жидкое. Температура плавления нитрата меди обычно составляет от 256°C до 260°C (от 493°F до 500°F). Крайне важно обращаться с этим веществом осторожно, чтобы избежать его разложения.
Плотность нитрата меди г/мл
Плотность нитрата меди относится к его массе на единицу объема. Плотность твердого нитрата меди обычно составляет около 2,32 г/мл, тогда как плотность его водных растворов может варьироваться в зависимости от концентрации.
Нитрат меди Молекулярный вес
Молекулярная масса нитрата меди представляет собой сумму атомных весов всех атомов в его химической формуле. Молекулярная масса Cu(NO3)2 составляет примерно 187,55 г/моль.
Структура нитрата меди
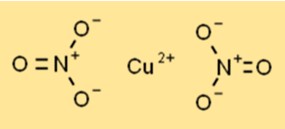
Нитрат меди существует в виде синего кристаллического твердого вещества с гексагональной кристаллической структурой. Каждый ион меди (Cu2+) окружен шестью атомами кислорода двух нитрат-ионов, образуя скоординированное расположение. Структура способствует его стабильности и реакционной способности в различных химических процессах.
Растворимость нитрата меди
Нитрат меди умеренно растворим в воде. При растворении в воде он образует водный раствор, который можно использовать в различных областях, таких как гальваника и в качестве реагента в химических реакциях. Однако его растворимость снижается с понижением температуры.
| Появление | Голубое кристаллическое вещество |
| Удельный вес | Н/Д |
| Цвет | Синий |
| Запах | Без запаха |
| Молярная масса | 187,55 г/моль |
| Плотность | 2,32 г/мл (твердый) |
| Точка плавления | 256–260°С (493–500°Ф) |
| Точка кипения | Разлагается перед кипячением |
| Мигающая точка | Н/Д |
| Растворимость в воде | Умеренно растворим, образует водный раствор |
| Растворимость | Растворим в воде |
| Давление газа | Н/Д |
| Плотность пара | Н/Д |
| пКа | Н/Д |
| рН | Кислота |
Безопасность и вред медной селитры
Нитрат меди представляет собой определенную проблему безопасности и опасности. Крайне важно обращаться с этим соединением с осторожностью. Прямой контакт с кожей или глазами может вызвать раздражение или ожоги. Вдыхание пыли или паров может вызвать раздражение дыхательных путей. При нагревании он может выделять токсичные оксиды азота. Вещество также является окислителем и может воспламенить легковоспламеняющиеся материалы при контакте. При работе с нитратом меди следует надевать соответствующие защитные средства, такие как перчатки и очки. Его следует хранить вдали от горючих материалов и несовместимых веществ, чтобы свести к минимуму потенциальные риски. Всегда соблюдайте инструкции по технике безопасности и используйте в хорошо проветриваемом помещении.
| Символы опасности | Окислитель, Коррозионный, Раздражающий |
| Описание безопасности | Ручка с залогом. Избегайте контакта с кожей и глазами. Используйте в хорошо проветриваемом помещении. Хранить вдали от горючих материалов. |
| Идентификационные номера ООН | ООН3085 |
| код ТН ВЭД | 28342910 |
| Класс опасности | 5.1 (Окислитель) |
| Группа упаковки | III |
| Токсичность | Вред при проглатывании. Может вызвать раздражение кожи и глаз. Вдыхание пыли или паров может вызвать раздражение дыхательных путей. |
Методы синтеза нитрата меди
Существует несколько методов синтеза нитрата меди.
Распространенный подход включает реакцию оксида меди (CuO) или гидроксида меди (Cu(OH)2) с азотной кислотой (HNO3) . При приготовлении нитрата меди к раствору азотной кислоты можно медленно добавлять оксид меди или гидроксид меди, что приводит к образованию нитрата меди и воды.
Другой метод включает реакцию между металлической медью (Cu) и концентрированной азотной кислотой. Металл Cu реагирует с азотной кислотой с образованием нитрата меди, диоксида азота (NO2) и воды. Этот метод требует осторожного обращения из-за образования токсичного газа диоксида азота.
Альтернативно вы можете растворить металлическую медь или оксид меди в смеси азотной кислоты и перекиси водорода (H2O2) для получения нитрата меди. Этот метод позволяет ускорить реакцию и получить чистый нитрат меди.
Наконец, реакция двойного замещения между CuSO4 и нитратом натрия (NaNO3) также может привести к образованию нитрата меди. При смешивании этих двух солей в воде нитрат меди выпадает в осадок, а побочный продукт сульфат натрия остается растворенным.
Соблюдайте меры предосторожности во время синтеза, поскольку используемые химические вещества проявляют реакционную способность. Используйте соответствующее защитное оборудование и применяйте надлежащие лабораторные методы, чтобы обеспечить успешный и безопасный синтез нитрата меди.
Применение нитрата меди
Нитрат меди находит разнообразное применение в различных отраслях промышленности благодаря своим уникальным свойствам. Некоторые известные варианты использования включают:
- Катализатор: действует как катализатор в органическом синтезе, способствуя таким реакциям, как превращение спиртов в альдегиды или кетоны.
- Пиротехника: Нитрат меди является ключевым компонентом пиротехнических составов, придающим пламени синий и зеленый цвета.
- Сельское хозяйство: В сельском хозяйстве он служит источником меди в удобрениях, обеспечивающих растения необходимыми питательными веществами.
- Окислитель: Нитрат меди активно окисляет другие вещества в ходе химических процессов.
- Металлическое покрытие: нитрат меди активно осаждает тонкий слой меди на различных металлических поверхностях во время процессов гальваники.
- Пигменты и красители: Нитрат меди активно способствует созданию зеленых и синих пигментов для керамики, стекла и текстиля.
- Фотографические процессы: нитрат меди активно способствует развитию изображения в некоторых фотографических растворах.
- Консервация: находит применение при консервации древесины, помогая закреплять консерванты.
- Получение других соединений меди: служит предшественником для синтеза различных материалов и соединений на основе меди.
Универсальность и реакционная способность нитрата меди делают его ценным химическим веществом в самых разных областях, от промышленных процессов до художественных применений.
Вопросы:
Вопрос: Что происходит при нагревании нитрата меди?
Ответ: При нагревании нитрат меди разлагается на оксид меди, газообразный диоксид азота и кислород.
Вопрос: Растворяется ли нитрат меди в воде?
Ответ: Да, нитрат меди умеренно растворим в воде.
Вопрос: Какова химическая формула нитрата меди?
Ответ: Химическая формула нитрата меди: Cu(NO3)2.
Вопрос: Является ли нитрат меди сильным электролитом?
Ответ: Да, нитрат меди является мощным электролитом, который при растворении в воде диссоциирует на ионы.
Вопрос: Каков заряд нитрата меди?
A: Нитрат меди имеет чистый заряд 0; это нейтральное соединение.
Вопрос: Сколько атомов азота содержится в 10,2 г нитрата меди(II)?
Ответ: В нем содержится примерно 0,161 моля нитрата меди(II) и, следовательно, примерно 0,322 моля атомов азота.
Вопрос: Сколько серебра можно получить из 3,00 молей меди и 3,85 молей нитрата серебра?
Ответ: Следуя сбалансированному химическому уравнению, можно получить 342,3 г серебра.
Вопрос: Растворим ли нитрат меди?
Ответ: Да, нитрат меди растворим в воде.
Вопрос: Какова формула нитрата меди(II)?
A: Формула нитрата меди(II) — Cu(NO3)2.
Вопрос: Что дает реакция замещения Cu(NO3)2 и Zn?
A: В реакции замещения образуются нитрат цинка (Zn(NO3)2) и металлическая медь (Cu).
Вопрос: Что такое Cu(NO3)2?
Ответ: Cu(NO3)2 — это химическая формула нитрата меди, кристаллического соединения синего цвета.
Вопрос: Что из перечисленного восстанавливается в следующей реакции? Cu(NO3)2 + Zn -> Zn(NO3)2 + Cu
Ответ: Медь (Cu) восстанавливается во время реакции, приобретая электроны с образованием металлической меди.
Вопрос: Образуется ли твердое вещество Cu(OH)2 при растворении 0,075 г КОН в 1,0 л Cu(NO3)2 1,0 × 10⁻³ М?
О: Нет, твердый Cu(OH)2 не образуется, поскольку Cu(NO3)2 полностью ионизируется в растворе и имеется избыток ионов OH⁻ из КОН.
