Нитрат лития (LiNO₃) — химическое соединение, используемое в различных областях. Он обладает уникальными свойствами, такими как растворимость в воде и его роль в производстве керамики и стекла.
| Название ИЮПАК | Нитрат лития |
| Молекулярная формула | LiNO₃ |
| Количество CAS | 7790-69-4 |
| Синонимы | Нитрат лития, литиевая соль азотной кислоты, нитрат лития (I) |
| ИнЧи | InChI=1S/Li.NO3/c;2-1(3)4/q+1;-1 |
Свойства нитрата лития
Формула нитрата лития
Формула литиевой соли азотной кислоты LiNO₃. Он состоит из одного атома лития (Li), одного атома азота (N) и трех атомов кислорода (О). Эта химическая формула представляет состав каждого элемента в соединении.
нитрат лития Молярная масса
Литиевая соль азотной кислоты имеет молярную массу примерно 68,95 г/моль. Молярная масса относится к массе одного моля вещества и рассчитывается путем сложения атомных масс всех атомов в формуле.
Температура кипения нитрата лития
Литиевая соль азотной кислоты имеет температуру кипения около 600°C (1112°F). Точка кипения — это температура, при которой вещество переходит из жидкости в газ при стандартном атмосферном давлении.
Температура плавления нитрата лития
Литиевая соль азотной кислоты имеет температуру плавления около 255°C (491°F). Точка плавления — это температура, при которой вещество переходит из твердого состояния в жидкость при стандартном атмосферном давлении.
Плотность нитрата лития г/мл
Плотность литиевой соли азотной кислоты составляет примерно 2,38 г/мл. Плотность представляет собой массу вещества на единицу объема и является важным свойством для понимания его физического поведения.
Молекулярный вес нитрата лития
Молекулярная масса литиевой соли азотной кислоты составляет 68,95 г/моль. Молекулярная масса представляет собой сумму атомных весов всех атомов молекулы и выражается в граммах на моль.
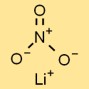
Структура нитрата лития
Литиевая соль азотной кислоты имеет ионную кристаллическую структуру, в которой катионы лития (Li⁺) и нитрат-анионы (NO₃⁻) образуют регулярный повторяющийся узор. Эта структура способствует его стабильности и характерным свойствам.
Растворимость нитрата лития
Литиевая соль азотной кислоты хорошо растворима в воде. Эта высокая растворимость является одной из его существенных характеристик и делает его полезным в различных применениях, например, в производстве керамики и стекла.
| Появление | Белый твердый |
| Удельный вес | Н/Д |
| Цвет | Белый |
| Запах | Без запаха |
| Молярная масса | 68,95 г/моль |
| Плотность | 2,38 г/мл |
| Точка плавления | 255°С (491°Ф) |
| Точка кипения | 600°С (1112°Ф) |
| Мигающая точка | Н/Д |
| Растворимость в воде | Очень растворим |
| Растворимость | Растворим в воде и органических растворителях, таких как этанол. |
| Давление газа | Н/Д |
| Плотность пара | Н/Д |
| пКа | Н/Д |
| рН | Н/Д |
Обратите внимание, что некоторые свойства могут быть неприменимы (нет данных) или иметь ограниченные данные для нитрата лития.
Безопасность и опасность нитрата лития
Литиевая соль азотной кислоты представляет определенные соображения безопасности и опасности. Он может вызывать раздражение кожи, глаз и дыхательных путей при контакте или вдыхании. При обращении важно использовать соответствующие средства защиты, такие как перчатки и защитные очки. Избегайте приема внутрь, так как это может вызвать дискомфорт в желудочно-кишечном тракте. Храните его вдали от несовместимых веществ, чтобы избежать опасных реакций. В случае возникновения разливов или утечек немедленно локализуйте и очистите их. Кроме того, всегда следуйте надлежащим правилам хранения и храните его в безопасном, хорошо проветриваемом помещении. Уделяйте приоритетное внимание методам безопасного обращения и следуйте соответствующим протоколам безопасности, чтобы минимизировать риски, связанные с литиевой солью азотной кислоты.
| Символы опасности | Предупреждение |
| Описание безопасности | – Раздражает кожу, глаза и дыхательные пути. – Избегайте проглатывания. – Используйте защитное оборудование. – Хранить в хорошо проветриваемом месте. |
| Идентификационные номера ООН | ООН1477 |
| код ТН ВЭД | 28342990 |
| Класс опасности | 5.1 (Окислитель) |
| Группа упаковки | II |
| Токсичность | Низкая токсичность, но с ним следует обращаться осторожно и с соблюдением соответствующих мер безопасности. |
Обратите внимание, что конкретные символы опасности и рекомендации по безопасности могут различаться в зависимости от юрисдикции и правил. Всегда обращайтесь к соответствующим паспортам безопасности и местным правилам техники безопасности при работе с литиевой солью азотной кислоты.
Методы синтеза нитрата лития
Существует несколько методов синтеза литиевой соли азотной кислоты.
Обычный подход включает реакцию между карбонатом лития (Li₂CO₃) и азотной кислотой (HNO₃) . Во время этого процесса два соединения реагируют с образованием литиевой соли азотной кислоты и воды (H₂O) в качестве побочных продуктов. Химическое уравнение этой реакции:
Li₂CO₃ + 2HNO₃ → 2LiNO₃ + H₂O
Другой метод заключается в реакции гидроксида лития (LiOH) с азотной кислотой с получением литиевой соли азотной кислоты и воды. Уравнение реакции:
LiOH + HNO₃ → LiNO₃ + H₂O
Литиевая соль азотной кислоты образуется путем нейтрализации азотной кислоты оксидом лития (Li₂O) или карбонатом лития. Уравнения:
Li₂O + 2HNO₃ → 2LiNO₃ + H₂O Li₂CO₃ + 2HNO₃ → 2LiNO₃ + CO₂ + H₂O
При использовании всех этих методов важно обращаться с реагентами и продуктами с осторожностью из-за их реакционной способности и потенциальных опасностей. Надлежащие меры безопасности и контролируемые условия необходимы в процессе синтеза для обеспечения успешного производства литиевой соли азотной кислоты.
Использование нитрата лития
Литиевая соль азотной кислоты находит разнообразное применение благодаря своим уникальным свойствам. Вот его использование:
- Очистка воздуха: литиевая соль азотной кислоты действует как осушитель при очистке воздуха, удаляя влагу из воздуха, предотвращая коррозию и поддерживая оптимальные условия окружающей среды.
- Реагенты в химическом синтезе: служит источником нитрат-ионов в различных химических реакциях, что делает его полезным в синтезе других соединений и веществ.
- Специальные химикаты: они находят применение в производстве специальных химикатов, включая катализаторы и ингибиторы коррозии.
- Пиротехника и фейерверки. Литиевая соль азотной кислоты играет решающую роль в качестве окислителя в пиротехнике, способствуя приданию фейерверкам ярко-красного цвета.
- Фармацевтическая промышленность. Фармацевтическая промышленность использует литиевую соль азотной кислоты в качестве реагента при химическом синтезе и исследованиях определенных фармацевтических составов.
- Литиевые батареи: литиевая соль азотной кислоты, хотя и не используется напрямую в батареях, имеет важное значение для производства литий-ионных батарей. Производители включают в электролиты, используемые в этих батареях, соли лития, полученные из литиевой соли азотной кислоты.
- Ядерные реакторы. Некоторые типы ядерных реакторов используют литиевую соль азотной кислоты в качестве теплоносителя из-за ее свойств поглощения нейтронов.
- Производство керамики и стекла. В процессах производства керамики и стекла литиевая соль азотной кислоты действует как флюс. Он эффективно снижает температуру плавления материалов, тем самым улучшая их обрабатываемость и качество продукции.
- Жидкости-теплоносители: литиевая соль азотной кислоты находит применение в жидкостях-теплоносителях, особенно в системах солнечной энергетики, из-за ее высокой растворимости в воде. Это способствует эффективному теплообмену и позволяет хранить тепловую энергию.
Вопросы:
Вопрос: Сколько всего атомов содержится в молекуле нитрата лития LiNO₃?
Ответ: В молекуле литиевой соли азотной кислоты 5 атомов: 1 атом лития (Li), 1 атом азота (N) и 3 атома кислорода (О).
Вопрос: Каковы правильные формулы гексагидрата нитрата меди (II) и дигидрата хромата лития?
A: Правильные формулы: Cu(NO₃)₂·6H₂O для гексагидрата нитрата меди(II) и Li₂CrO₄·2H₂O для дигидрата хромата лития.
Вопрос: Сколько граммов нитрата лития понадобится для приготовления 250 мл 0,5 М раствора?
Ответ: Для приготовления 250 мл 0,5 М раствора вам понадобится 17,24 грамма литиевой соли азотной кислоты.
Вопрос: Нитрат лития ионный или ковалентный?
A: Литиевая соль азотной кислоты является ионным соединением.
Вопрос: Растворим ли LiNO₃ в воде?
О: Да, нитрат лития (LiNO₃) растворим в воде.
Вопрос: Какой коэффициент должен стоять перед LiNO₃ в сбалансированном уравнении?
О: Коэффициент «2» должен стоять перед LiNO₃ в сбалансированном уравнении.
Вопрос: Сколько из следующих соединений растворимы в воде? Pb(OH)₂, LiNO₃, NH₄Br, K₂S
A: Три соединения водорастворимы: LiNO₃, NH₄Br и K₂S.
Вопрос: Растворим ли LiNO₃?
О: Да, LiNO₃ растворим.
Вопрос: LiNO₃ водный или твердый?
Ответ: LiNO₃ является водным при растворении в воде.
Вопрос: Является ли LiNO₃ кислотным, основным или нейтральным?
A: Литиевая соль азотной кислоты (LiNO₃) является нейтральным соединением.
Вопрос: Сколько всего атомов содержится в молекуле нитрата лития LiNO₃?
Ответ: В молекуле нитрата лития 5 атомов: 1 атом лития (Li), 1 атом азота (N) и 3 атома кислорода (O).
Вопрос: Является ли LiNO₃ ионным или ковалентным?
Ответ: LiNO₃ — ионное соединение.
