Хлорид ртути – токсичное соединение с формулой HgCl2. Это белое кристаллическое твердое вещество, используемое в лабораториях в качестве реагента и дезинфицирующего средства, но при этом необходимо правильное обращение.
| Название ИЮПАК | Хлорид ртути(II) |
| Молекулярная формула | HgCl2 |
| Количество CAS | 7487-94-7 |
| Синонимы | Дихлорид ртути, дихлорид ртути, бихлорид ртути, дихлорид ртути (II) |
| ИнЧИ | InChI=1S/2ClH.Hg/h2*1H;/q;;+2/p-2 |
Свойства хлорида сулемы
Формула хлорида ртути
Формула дихлорида ртути: HgCl2. Он состоит из одного атома ртути (Hg) и двух атомов хлора (Cl). Это соединение также известно как хлорид ртути(II), что символизирует степень окисления ртути +2.
Молярная масса хлорида ртути
Молярная масса дихлорида ртути составляет приблизительно 271,52 г/моль. Он рассчитывается путем сложения атомных масс одного атома ртути (200,59 г/моль) и двух атомов хлора (по 35,45 г/моль каждый).
Температура кипения хлорида сулемы
Дихлорид ртути имеет температуру кипения примерно 302°C (575,6°F). При этой температуре твердый дихлорид ртути превращается в пар.
Температура плавления хлорида сулемы
Температура плавления дихлорида ртути составляет примерно -71°C (-95,8°F). При этой температуре твердый дихлорид ртути превращается в жидкость.
Плотность хлорида сулемы г/мл
Плотность дихлорида ртути составляет примерно 5,4 г/мл. Такая высокая плотность делает его относительно тяжелым веществом.
Хлорид ртути Молекулярный вес
Молекулярная масса дихлорида ртути составляет примерно 271,52 г/моль. Он указывает массу одного моля соединения и соответствует сумме его атомных весов.
Структура хлорида сулемы
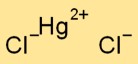
Дихлорид ртути имеет кристаллическую структуру. Он состоит из положительно заряженных ионов ртути (Hg2+) и отрицательно заряженных ионов хлорида (Cl-), удерживаемых вместе ионными связями. Композиция образует решетчатый узор.
Растворимость хлорида сулемы
Дихлорид ртути имеет ограниченную растворимость в воде. Примерно 7,7 граммов дихлорида ртути растворяется в 100 мл воды при комнатной температуре (20°С). Его растворимость увеличивается с повышением температуры.
Дихлорид ртути является высокотоксичным веществом, с которым следует обращаться с особой осторожностью. Он широко используется в различных областях, в том числе в качестве реагента в химических лабораториях, в качестве дезинфицирующего средства и в гальванических процессах. Из-за его токсичности при работе с этим соединением важно соблюдать надлежащие протоколы безопасности.
| Появление | Белое кристаллическое твердое вещество |
| Удельный вес | 5,4 г/мл |
| Цвет | Белый |
| Запах | Без запаха |
| Молярная масса | 271,52 г/моль |
| Плотность | 5,4 г/мл |
| Точка плавления | -71°C (-95,8°F) |
| Точка кипения | 302°С (575,6°Ф) |
| Мигающая точка | Непригодный |
| Растворимость в воде | Лимит |
| Растворимость | Растворим в органических растворителях, таких как спирт, эфир. |
| Давление газа | Незначительный |
| Плотность пара | 8,23 (воздух = 1) |
| пКа | Непригодный |
| рН | Кислота (в воде) |
Безопасность и опасность хлористой сулемы
Дихлорид ртути представляет значительную угрозу безопасности из-за своей чрезвычайной токсичности. Прямой контакт с кожей или вдыхание его паров может вызвать серьезные проблемы со здоровьем. Крайне важно обращаться с ним очень осторожно, используя соответствующие средства защиты, такие как перчатки и респиратор. Всегда работайте в хорошо проветриваемом помещении, чтобы свести к минимуму воздействие. Храните его в плотно закрытой таре, вдали от несовместимых веществ. В случае проглатывания или случайного воздействия немедленно обратитесь за медицинской помощью. Необходимо соблюдать надлежащие методы утилизации, чтобы избежать загрязнения окружающей среды. В целом, строгое соблюдение протоколов безопасности имеет решающее значение при работе с дихлоридом ртути.
| Символы опасности | Череп и скрещенные кости, коррозийные |
| Описание безопасности | Очень токсично и коррозийно. Используйте с особой осторожностью. Избегайте прямого контакта и вдыхания паров. |
| Идентификационные номера ООН | ООН 1624 (Соединения ртути, н.у.к.) |
| код ТН ВЭД | 2852.10.10 |
| Класс опасности | 6.1 (Токсичные вещества) |
| Группа упаковки | II (средний уровень) |
| Токсичность | Чрезвычайно токсичен для человека и животных. Обращайтесь с осторожностью и соблюдайте строгие протоколы безопасности. |
Методы синтеза хлорида сулемы
Существуют различные методы синтеза дихлорида ртути.
Распространенный подход предполагает реакцию металлической ртути с соляной кислотой . В контролируемой среде добавьте ртуть в кислоту для получения дихлорида ртути и выделения газообразного водорода. Химическое уравнение этой реакции:
Hg + 2HCl -> HgCl2 + H2
Другой метод использует реакцию между оксидом ртути (HgO) и соляной кислотой . Соедините оксид ртути с кислотой, чтобы получить дихлорид ртути и воду:
HgO + 2HCl -> HgCl2 + H2O
Кроме того, дихлорид ртути можно получить путем реакции ртути с газообразным хлором:
Hg + Cl2 -> HgCl2
Помните, что синтез дихлорида ртути следует проводить только под хорошо вентилируемым вытяжным шкафом или в контролируемых условиях из-за его токсичной и коррозионной природы. Осторожное обращение и соблюдение мер предосторожности необходимы во избежание вредного воздействия в процессе синтеза.
Использование хлорида сулемы
Дихлорид ртути, также известный как хлорид ртути(II), благодаря своим уникальным свойствам нашел различное применение в различных областях. Вот некоторые из его основных применений:
Лабораторный реагент: Дихлорид ртути служит важным реагентом в химических лабораториях для различных аналитических и синтетических процедур.
Дезинфицирующее средство: сильные антимикробные свойства делают его ценным в качестве дезинфицирующего средства, особенно для стерилизации оборудования и поверхностей.
Медицина: Хотя его использование ограничено из-за его токсичности, оно используется в традиционной медицине при определенных состояниях.
Фотография. В прошлом хлорид ртути играл роль в ранней фотографии в качестве фиксирующего агента для проявления фотографий.
Гальваника. В процессах гальваники люди используют дихлорид ртути в качестве электролита для нанесения металлических покрытий на различные предметы.
Консервация древесины: на протяжении всей истории люди использовали его для обработки древесины, защищая ее от гниения и вредителей.
Текстильная промышленность: Производители использовали хлорную ртуть для удаления цвета с текстиля в процессе крашения.
Аналитическая химия: химики используют ее для конкретных тестов и реакций химического анализа.
Нишевый органический синтез: находит применение в конкретных реакциях органического синтеза.
Фунгицид и альгицид: фермеры активно используют его в качестве фунгицида и альгицида для контроля роста грибов и водорослей в сельском хозяйстве.
Вопросы:
Вопрос: HgCl2 растворим или нерастворим в воде?
Ответ: HgCl2 мало растворим в воде.
Вопрос: Что такое катион и анион соединения HgCl2?
A: Катион — Hg2+ (ртуть), анион — Cl- (хлорид).
Вопрос: Является ли HgCl2 ионным или ковалентным?
Ответ: HgCl2 — ионное соединение.
Вопрос: Как сделать хлорид ртути в Minecraft?
О: В Minecraft дихлорид ртути можно синтезировать, объединив ртуть и хлор на верстаке.
Вопрос: Для чего используется хлорид ртути?
Ответ: Дихлорид ртути используется в лабораториях в качестве реагента и дезинфицирующего средства.
Вопрос: Кто изобрел хлорид сулемы?
Ответ: Открытие и первое использование дихлорида ртути относятся к древним временам, поэтому конкретного инвентаря не существует.
Вопрос: Как создать хлорид ртути в Minecraft Education Edition?
О: В Minecraft Education Edition дихлорид ртути можно создать путем объединения ртути и хлора на верстаке, как и в стандартной версии Minecraft.
Вопрос: Что такое хлорид ртути?
Ответ: Дихлорид ртути — токсичное соединение с химической формулой HgCl2.
Вопрос: Является ли HgCl2 твердым веществом?
Ответ: Да, HgCl2 является твердым веществом при комнатной температуре.
Вопрос: Как правильно называть HgCl2 в ионном обозначении?
Ответ: Правильное название HgCl2 в ионном обозначении — дихлорид ртути(II).
Вопрос: Как называется HgCl2?
A: Название HgCl2 — дихлорид ртути.
Вопрос: 2 HgCl2(водн.) + C2O4^(2-)(водн.) → 2 Cl^-(водн.) + 2 CO2(г) + Hg2Cl2(тв), каков закон скорости реакции?
A: Закон скорости: Скорость = k[HgCl2]^2[C2O4^2-] (второй порядок по HgCl2 и первый порядок по C2O4^2-).
