Бикарбонат аммония представляет собой белое кристаллическое соединение, используемое при выпечке в качестве уходового средства. При нагревании он выделяет углекислый газ, в результате чего выпечка получается легкой и пышной.
| Название ИЮПАК | Бикарбонат аммония |
| Молекулярная формула | NH4HCO3 |
| Количество CAS | 1066-33-7 |
| Синонимы | Кислый карбонат аммония; хлебопекарный аммиак; Аммониевая соль угольной кислоты (1:1); Гидрокарбонат аммония |
| ИнЧИ | InChI=1S/CH2O3.H3N/c2-1(3)4;/h(H2,2,3,4);1H3 |
Обратите внимание, что предоставленное значение InChI является упрощенным и может быть неполным.
Свойства бикарбоната аммония
Формула бикарбоната аммония
Химическая формула бикарбоната аммония: NH4HCO3. Он состоит из иона аммония (NH4+) и иона бикарбоната (HCO3-). Эта формула представляет собой состав соединения, указывающий на наличие аммониевой и бикарбонатной групп.
Молярная масса бикарбоната аммония
Молярную массу гидрокарбоната аммония рассчитывают путем сложения атомных масс составляющих его элементов. Молярная масса гидрокарбоната аммония (NH4HCO3) составляет примерно 79,06 грамм на моль. Это значение важно для различных химических расчетов и преобразований.
Температура кипения бикарбоната аммония
Гидрокарбонат аммония не имеет четко выраженной температуры кипения, поскольку при нагревании разлагается на газообразные продукты. Однако процесс разложения начинается примерно при температуре от 60 до 70 градусов по Цельсию. При повышении температуры соединение распадается на аммиак (NH3), воду (H2O) и углекислый газ (CO2).
Температура плавления бикарбоната аммония
Температура плавления гидрокарбоната аммония составляет примерно от 41 до 60 градусов Цельсия. При нагревании соединение подвергается сублимации, переходя непосредственно из твердого состояния в газообразное, минуя жидкую фазу.
Плотность бикарбоната аммония г/мл
Плотность гидрокарбоната аммония составляет примерно 1,59 грамма на миллилитр (г/мл) при комнатной температуре. Это значение представляет собой массу соединения на единицу объема. Плотность гидрокарбоната аммония влияет на его поведение в различных применениях и его растворимость в различных растворителях.
Молекулярный вес бикарбоната аммония
Молекулярная масса гидрокарбоната аммония составляет примерно 79,06 грамма на моль. Это значение получается сложением атомных масс элементов, присутствующих в соединении (азота, водорода, углерода и кислорода). Молекулярный вес важен для расчета количества гидрокарбоната аммония, необходимого для химических реакций.
Структура бикарбоната аммония
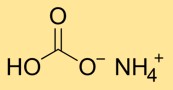
Гидрокарбонат аммония имеет кристаллическую структуру, состоящую из ионов аммония (NH4+) и бикарбоната (HCO3-). Ион аммония образуется сочетанием одного атома азота и четырех атомов водорода, а ион бикарбоната состоит из одного атома углерода, связанного с тремя атомами кислорода.
Растворимость бикарбоната аммония
Гидрокарбонат аммония хорошо растворим в воде. Он легко растворяется в водных растворах, выделяя ионы аммония и ионы бикарбоната. Однако его растворимость уменьшается с температурой. Он плохо растворяется в спирте и нерастворим в большинстве органических растворителей.
| Появление | Белый кристаллический порошок |
| Удельный вес | 1586 г/см³ |
| Цвет | Бесцветный |
| Запах | Запах аммиака |
| Молярная масса | 79,06 г/моль |
| Плотность | 1,59 г/мл |
| Точка плавления | 41-60°С |
| Точка кипения | Разложившийся |
| Мигающая точка | Непригодный |
| Растворимость в воде | Растворимый |
| Растворимость | Растворим в воде; плохо растворяется в спирте |
| Давление газа | Непригодный |
| Плотность пара | Непригодный |
| пКа | Непригодный |
| рН | ~7 |
Обратите внимание, что предоставленные значения являются приблизительными и могут варьироваться в зависимости от таких факторов, как чистота и условия окружающей среды.
Безопасность и опасность бикарбоната аммония
Гидрокарбонат аммония представляет определенные соображения безопасности и опасности. Он может раздражать глаза, кожу и дыхательную систему при контакте или вдыхании. Прямое воздействие может вызвать дискомфорт, включая ощущение жжения. Важно обращаться с составом осторожно и использовать соответствующие средства индивидуальной защиты, такие как перчатки и очки. Кроме того, гидрокарбонат аммония при нагревании может выделять вредный газообразный аммиак, поэтому в таких ситуациях необходима адекватная вентиляция. Состав не горюч и не имеет определенной температуры воспламенения. Правильное хранение, маркировка и соблюдение протоколов безопасности необходимы для минимизации рисков, связанных с обращением и использованием гидрокарбоната аммония.
| Символы опасности | Си (раздражает) |
| Описание безопасности | – Избегайте попадания в глаза, на кожу и вдыхание.\n- Используйте соответствующие средства индивидуальной защиты.\n- Обеспечьте достаточную вентиляцию при обращении.\n- Храните правильно и маркируйте контейнеры.\n — Соблюдайте протоколы безопасности. |
| Идентификационные номера ООН | Непригодный |
| код ТН ВЭД | 28369990 |
| Класс опасности | Неклассифицированный |
| Группа упаковки | Неклассифицированный |
| Токсичность | Низкая токсичность; раздражает глаза, кожу и дыхательную систему. |
Обратите внимание, что предоставленная информация носит общий характер и может не охватывать все аспекты безопасности и опасностей гидрокарбоната аммония. Для получения полной информации важно обращаться к конкретным паспортам безопасности и правилам.
Методы синтеза бикарбоната аммония
Существует несколько методов синтеза гидрокарбоната аммония.
Распространенный метод включает реакцию между газообразным аммиаком (NH3) и диоксидом углерода (CO2) в водном растворе. В этом процессе вы барботируете два газа непосредственно в воду, и вода образует раствор гидрокарбоната аммония. Затем вы концентрируете и кристаллизуете раствор, чтобы получить твердое соединение.
Другой подход — это реакция между аммиаком и углекислым газом в растворителе, таком как метанол или этанол. Реакция протекает под давлением и при высокой температуре, в результате чего образуются кристаллы гидрокарбоната аммония.
Обработка карбоната аммония диоксидом углерода дает бикарбонат аммония и воду. Карбонат аммония , будь то в твердой форме или в растворе, реагирует с диоксидом углерода с образованием бикарбоната аммония.
Для синтеза гидрокарбоната аммония можно соединить аммиак с угольной кислотой. Угольная кислота образуется при растворении углекислого газа в воде, а добавление аммиака к полученному раствору угольной кислоты дает гидрокарбонат аммония.
Убедитесь, что синтез гидрокарбоната аммония происходит в хорошо проветриваемом помещении из-за выделения газообразного аммиака во время реакций. Соблюдайте соответствующие меры предосторожности и протоколы обращения, чтобы обеспечить безопасный и эффективный процесс синтеза.
Использование бикарбоната аммония
Гидрокарбонат аммония находит различное применение в различных отраслях промышленности и применениях. Вот некоторые из его распространенных применений:
- Выпечка: гидрокарбонат аммония используется в качестве разрыхлителя при выпечке, особенно при изготовлении печенья, крекеров и других хлебобулочных изделий. При нагревании он выделяет углекислый газ, создавая легкую, хрустящую текстуру.
- Производство аммиака: гидрокарбонат аммония служит промежуточным соединением при производстве аммиака. Он способен расщепляться на аммиак и углекислый газ, которые затем можно разделить и использовать для различных целей.
- Сельское хозяйство: Фермеры используют его в качестве источника азота в удобрениях, чтобы обеспечить необходимые питательные вещества для роста растений. Растения легко усваивают его благодаря растворимости в воде.
- Контроль pH. Промышленность использует гидрокарбонат аммония для регулирования уровня pH в таких процессах, как очистка воды, производство красителей и пигментов.
- Огнетушители: в некоторых порошковых огнетушителях этот состав используется в качестве огнетушителя. Он тушит пламя и нарушает процесс горения.
- Чистящее средство: в некоторых отраслях его используют в качестве чистящего средства для удаления грязи, жира и загрязнений с поверхностей.
- Текстильная и кожевенная промышленность. В процессах крашения и печати текстиля и кожаных изделий гидрокарбонат аммония помогает закрепить красители и улучшить стойкость цвета.
- Фармацевтическое применение: находит применение в некоторых фармацевтических составах в качестве буферного агента или ингредиента в медицинских таблетках.
Разнообразные применения гидрокарбоната аммония подчеркивают его универсальность и полезность во многих отраслях промышленности, включая хлебопекарную промышленность, сельское хозяйство, контроль pH, пожаротушение и различные производственные процессы.
Вопросы:
Вопрос: Вреден ли для вас бикарбонат аммония?
Ответ: Гидрокарбонат аммония может быть вредным при проглатывании или вдыхании в больших количествах, вызывая раздражение дыхательных путей и кожи. С ним следует обращаться и использовать с соответствующими мерами предосторожности.
Вопрос: Как отделить карбонат аммония от бикарбоната аммония?
Ответ: Карбонат аммония можно отделить от гидрокарбоната аммония путем нагревания смеси, поскольку бикарбонат аммония распадается на аммиак, углекислый газ и воду, оставляя после себя карбонат аммония.
Вопрос: Как рассчитать pH бикарбоната аммония в воде?
A: pH гидрокарбоната аммония в воде можно рассчитать с помощью уравнения Хендерсона-Хассельбаха: pH = pKa + log([A-]/[HA]), где pKa — константа диссоциации кислоты, а [A-]/[ HA] представляет собой отношение сопряженного основания к кислоте.
Вопрос: Как отрегулировать pH буфера на основе бикарбоната аммония?
Ответ: pH буферного раствора гидрокарбоната аммония можно регулировать путем добавления либо сильной кислоты для снижения pH, либо сильного основания для повышения pH, сохраняя при этом соответствующее соотношение бикарбоната аммония и его сопряженного основания.
Вопрос: Безопасен ли бикарбонат аммония в пищевых продуктах?
Ответ: Гидрокарбонат аммония обычно считается безопасным (GRAS) для использования в пищевых продуктах, но его необходимо использовать в соответствии с нормативными требованиями и в соответствующих количествах.
Вопрос: Что такое буфер из бикарбоната аммония?
A: Буфер гидрокарбоната аммония представляет собой раствор, содержащий гидрокарбонат аммония и сопряженное с ним основание (или кислоту), используемый для поддержания стабильного pH в различных биохимических и биологических приложениях.
Вопрос: Какова молекулярная масса бикарбоната аммония?
A: Молекулярная масса гидрокарбоната аммония составляет примерно 79,06 г/моль.
Вопрос: Каков массовый процентный состав водорода в NH4HCO3?
A: Массовый процентный состав водорода в NH4HCO3 составляет примерно 6,57%.
Вопрос: NH4HCO3 — кислота или основание?
Ответ: NH4HCO3 может действовать как кислота и основание, в зависимости от контекста. Он может отдавать протон (H+), действуя как кислота, или принимать протон, действуя как основание.
Вопрос: Как называется соединение с формулой NH4HCO3?
Ответ: Соединение формулы NH4HCO3 называется гидрокарбонатом аммония.
Вопрос: Является ли NH4HCO3 ионным или ковалентным?
Ответ: NH4HCO3 считается ионным соединением из-за присутствия в его структуре иона аммония (NH4+) и иона гидрокарбоната (HCO3-).
