Сульфат никеля (NiSO4) представляет собой соединение, состоящее из атомов никеля, серы и кислорода. Он обычно используется в гальванотехнике, катализаторах и в качестве питательного вещества в некоторых удобрениях.
| Название ИЮПАК | Сульфат никеля(II) |
| Молекулярная формула | NiSO4 |
| Количество CAS | 7786-81-4 |
| Синонимы | Сульфат никеля, соль никеля серной кислоты, сульфат никеля (II), никель (2+); сульфат |
| ИнЧИ | InChI=1S/Ni.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 |
Свойства сульфата никеля
Формула сульфата никеля
Химическая формула сульфата никеля — NiSO4. Он представляет собой комбинацию атома никеля (Ni) и сульфатной группы (SO4). В формуле четко указано наличие никеля и серы, а также кислорода в сульфатной группе.
Молярная масса сульфата никеля
Молярная масса сульфата никеля (NiSO4) рассчитывается путем сложения атомных масс составляющих его элементов. Никель (Ni) имеет атомную массу примерно 58,69 грамма на моль, в то время как сера (S) имеет атомную массу примерно 32,07 грамма на моль, а кислород (O) имеет атомную массу примерно 16 граммов на моль. Сложив эти значения, можно определить молярную массу сульфата никеля примерно 154,76 грамма на моль.
Температура кипения сульфата никеля
Сульфат никеля не имеет определенной температуры кипения, поскольку при нагревании разлагается. Однако важно отметить, что на температуру его разложения влияют такие факторы, как давление и присутствие других веществ. Поэтому рекомендуется с осторожностью обращаться с сульфатом никеля при воздействии высоких температур.
Сульфат никеля Температура плавления
Температура плавления сульфата никеля составляет около 100 градусов Цельсия (212 градусов по Фаренгейту). При этой температуре твердая форма сульфата никеля переходит в жидкое состояние. Стоит отметить, что изменения чистоты и кристаллической структуры сульфата никеля могут незначительно влиять на его температуру плавления.
Плотность сульфата никеля г/мл
Плотность сульфата никеля относится к его массе на единицу объема. Плотность сульфата никеля обычно составляет около 3,68 грамма на миллилитр (г/мл). Следует отметить, что плотность может меняться в зависимости от температуры и чистоты образца.
Молекулярный вес сульфата никеля
Молекулярная масса сульфата никеля (NiSO4) представляет собой сумму атомных масс входящих в его состав элементов. Как упоминалось ранее, молекулярная масса сульфата никеля составляет примерно 154,76 грамма на моль.
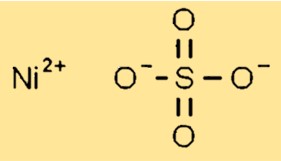
Структура сульфата никеля
Сульфат никеля имеет кристаллическую структуру в твердом состоянии. Он образует моноклинные кристаллы, в которых каждый ион никеля (Ni2+) окружен шестью атомами кислорода из сульфатных групп. Сульфатные группы расположены таким образом, чтобы обеспечить эффективное уплотнение кристаллической решетки.
Растворимость сульфата никеля
Сульфат никеля имеет умеренную растворимость в воде. Он легко растворяется в воде, его растворимость увеличивается с повышением температуры. Присутствие других ионов и веществ может влиять на его растворимость. Кроме того, сульфат никеля может образовывать гидраты при соединении с молекулами воды, что приводит к образованию различных гидратов сульфата никеля.
| Появление | Синие/зеленые кристаллы |
| Удельный вес | 3,68 г/мл |
| Цвет | Цвет морской волны |
| Запах | Без запаха |
| Молярная масса | 154,76 г/моль |
| Плотность | 3,68 г/мл |
| Точка плавления | 100°С (212°Ф) |
| Точка кипения | Разложившийся |
| Мигающая точка | Непригодный |
| Растворимость в воде | Очень растворим |
| Растворимость | Растворим в воде и органических растворителях, таких как этанол. |
| Давление газа | Непригодный |
| Плотность пара | Непригодный |
| пКа | -1,1 (серная кислота) |
| рН | Кислота (около 4) |
Безопасность и опасность сульфата никеля
Сульфат никеля представляет определенные риски для безопасности, которые необходимо учитывать. Крайне важно обращаться с ним осторожно, чтобы избежать потенциальных рисков. Прямой контакт с кожей следует свести к минимуму, так как он может вызвать раздражение или повышенную чувствительность кожи. Следует избегать проглатывания или вдыхания сульфата никеля, поскольку это может вызвать неблагоприятные последствия для здоровья. При работе с сульфатом никеля следует надевать соответствующие средства индивидуальной защиты, такие как перчатки и очки, чтобы избежать контакта с веществом. Сульфат никеля следует хранить в сухом прохладном месте вдали от несовместимых материалов. При работе с сульфатом никеля необходима соответствующая вентиляция, чтобы свести к минимуму концентрацию частиц в воздухе.
| Символы опасности | Никто |
| Описание безопасности | — Избегайте контакта с кожей – Избегайте проглатывания и вдыхания – Носите соответствующие средства индивидуальной защиты. |
| Идентификаторы Организации Объединенных Наций | Непригодный |
| код ТН ВЭД | 2833,25 |
| Класс опасности | Неклассифицированный |
| Группа упаковки | Непригодный |
| Токсичность | Может вызвать раздражение или повышенную чувствительность кожи |
Методы синтеза сульфата никеля
Существуют разные методы синтеза сульфата никеля.
Общий подход включает реакцию металлического никеля или оксида никеля с серной кислотой . В этом методе серная кислота растворяет металлический Ni или оксид никеля, в результате чего образуется сульфат никеля. Вы можете проводить реакцию в контролируемых условиях, таких как температура и перемешивание, чтобы обеспечить эффективную конверсию.
Другой метод предполагает реакцию серной кислоты с карбонатом никеля. Серная кислота растворяет карбонат никеля с образованием сульфата никеля. Химики обычно используют этот метод, когда у них есть легкодоступный карбонат никеля, поскольку он является удобным исходным материалом.
Кроме того, серная кислота может растворять гидроксид никеля для синтеза NiSO4. Растворение гидроксида никеля в серной кислоте приводит к образованию NiSO4. Этот метод подходит, когда нужно использовать гидроксид никеля в качестве предшественника для синтеза сульфата никеля.
Важно отметить, что в процессе синтеза необходимо соблюдать надлежащие меры предосторожности. Это включает в себя использование соответствующего защитного оборудования и процедур обращения. Проводите реакции в хорошо проветриваемом помещении, чтобы свести к минимуму риск воздействия вредных паров. Тщательный контроль параметров реакции, таких как температура и концентрация, имеет решающее значение для обеспечения оптимальной конверсии сульфата никеля и выхода.
Использование сульфата никеля
Сульфат никеля имеет различное применение в разных отраслях промышленности. Вот некоторые из его распространенных применений:
- Гальваника. В процессах гальваники широко используется сульфат никеля для создания прочного, устойчивого к коррозии покрытия на металлических поверхностях. Сульфат никеля улучшает внешний вид, твердость и прочность таких предметов, как ювелирные изделия, автозапчасти и кухонная утварь.
- Катализатор: Сульфат никеля действует как катализатор во многих химических реакциях, включая процессы гидрирования и окисления. Промышленность использует катализаторы на основе сульфата никеля в производстве фармацевтических препаратов, нефтехимии и тонкой химии.
- Аккумуляторы. Аккумуляторы, особенно Ni-Cd и Ni-MH, содержат сульфат никеля в качестве важного компонента. Сульфат никеля облегчает электродные реакции и обеспечивает эффективное хранение и выделение электрической энергии.
- Удобрение: в некоторых удобрениях используется растворимый Ni из сульфата никеля, чтобы обеспечить растения необходимыми питательными веществами. Никель играет решающую роль в различных обменных процессах в растениях, способствуя их росту и развитию.
- Текстиль: Текстильная промышленность использует сульфат никеля в процессах крашения и печати для улучшения стойкости цвета и поглощения красителей тканями. Сульфат никеля обеспечивает яркий и стойкий цвет.
- Фармацевтика: Сульфат никеля находит применение в фармацевтических препаратах, в основном для производства лекарств, содержащих Ni в качестве активного ингредиента, или для составления конкретных комплексов Ni, используемых в медицинских исследованиях.
- Исследования и разработки. Лаборатории используют сульфат никеля для различных целей исследований и разработок, включая химический синтез, электрохимические исследования и исследования в области материаловедения.
Вопросы:
Вопрос: Какова формула сульфата никеля (II)?
Ответ: Формула сульфата никеля(II) — NiSO4.
Вопрос: Металлический хром добавляют в раствор сульфата никеля(II). Что такое сбалансированная химическая реакция?
A: Сбалансированная химическая реакция: Cr + NiSO4 -> CrSO4 + Ni.
Вопрос: Как сделать сульфат никеля-аммония?
Ответ: Сульфат никеля-аммония можно получить растворением сульфата никеля и сульфата аммония в воде с последующей кристаллизацией.
Вопрос: Растворим ли сульфат никеля в воде?
Ответ: Да, сульфат никеля растворим в воде.
Вопрос: Кто добывает сульфат никеля?
Ответ: Сульфат никеля не добывается напрямую. Добывают никелевые руды, из которых можно производить сульфат никеля.
Вопрос: Как называется соединение NiSO4?
Ответ: Соединение NiSO4 называется сульфатом никеля.
Вопрос: Сколько граммов NiSO4 содержится в 100 г гидрата? Сколько родинок?
О: Количество NiSO4 в 100 г гидрата зависит от конкретного гидратного соединения и его молярной массы.
Вопрос: Растворим ли NiSO4 в воде?
О: Да, NiSO4 растворим в воде.
Вопрос: Сколько граммов NiSO4 получится, если выход 76,9%?
О: Полученное количество NiSO4 в граммах зависит от исходного количества и условий реакции.
Вопрос: Опасен ли NiSO4?
О: NiSO4 может быть опасен при неправильном обращении. При работе с ним важно соблюдать правила техники безопасности.
Вопрос: Как называется ковалентное соединение NiSO4?
Ответ: NiSO4 не является ковалентным соединением. Это ионное соединение, называемое сульфатом никеля.
Вопрос: Является ли NiSO4 солью?
О: Да, NiSO4 считается солью из-за ее ионной природы и ее образования в результате реакции между кислотой (серной кислотой) и основанием (гидроксидом никеля).
Вопрос: Каков заряд NiSO4?
Ответ: В NiSO4 ион никеля (Ni2+) несет положительный заряд 2+, а ион сульфата (SO4 2-) несет отрицательный заряд 2-.
