Оксихлорид фосфора (POCl3) — химическое соединение, используемое в различных промышленных процессах. Реагирует с водой с образованием фосфорной и соляной кислот.
| Название ИЮПАК | оксихлорид фосфора |
| Молекулярная формула | POCl3 |
| Количество CAS | 10025-87-3 |
| Синонимы | Фосфорилхлорид, фосфорилтрихлорид, трихлорид фосфора |
| ИнЧИ | ИнХИ=1S/Cl3OP/c1-4(2)3 |
Свойства хлорокиси фосфора
Формула оксихлорида фосфора
Химическая формула фосфорилхлорида: POCl3. Он состоит из одного атома фосфора (P), обозначаемого буквой P, и трех атомов хлора (Cl), обозначаемых Cl. Формула указывает соотношение каждого элемента, присутствующего в соединении.
Молярная масса оксихлорида фосфора
Молярную массу фосфорилхлорида можно рассчитать путем сложения атомных масс составляющих его элементов. Фосфор имеет молярную массу 30,97 г/моль, а хлор имеет молярную массу 35,45 г/моль. Умножение молярной массы хлора на 3 и добавление молярной массы фосфора дает общую молярную массу фосфорилхлорида примерно 153,33 г/моль.
Температура кипения оксихлорида фосфора
Фосфорилхлорид имеет температуру кипения около 105,5°С. Эта температура представляет собой точку, в которой жидкое соединение переходит в газообразное состояние при стандартном атмосферном давлении. Температура кипения является важной характеристикой, влияющей на обращение и применение фосфорилхлорида.
Оксихлорид фосфора Температура плавления
Температура плавления фосфорилхлорида составляет примерно -112,5°С. Это означает температуру, при которой твердое соединение переходит в жидкое состояние. Температура плавления является критическим параметром при хранении и транспортировке.
Плотность оксихлорида фосфора г/мл
Плотность фосфорилхлорида составляет примерно 1,65 г/мл. Плотность относится к количеству массы в единице объема вещества. Более высокая плотность предполагает большую концентрацию частиц в данном объеме.
Молекулярный вес оксихлорида фосфора
Молекулярную массу фосфорилхлорида рассчитывают путем сложения атомных масс составляющих его элементов. Молекулярная масса фосфора составляет примерно 30,97 г/моль, а молекулярная масса хлора составляет 35,45 г/моль. Сложение взвешенных масс дает приблизительную молекулярную массу фосфорилхлорида 153,33 г/моль.
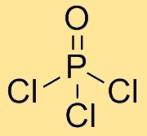
Структура оксихлорида фосфора
Фосфорилхлорид имеет молекулярную структуру, в которой один атом фосфора связан с тремя атомами хлора и одним атомом кислорода. Атомы хлора расположены симметрично вокруг центрального атома фосфора, причем атом кислорода также связан с атомом фосфора. Такое расположение образует тетраэдрическую геометрию.
Растворимость оксихлорида фосфора
Фосфорилхлорид плохо растворяется в воде, но легко растворяется в органических растворителях, таких как бензол, четыреххлористый углерод и хлороформ. Его растворимость объясняется полярной природой молекулы и наличием электроотрицательных атомов, таких как кислород и хлор.
| Появление | Бесцветная жидкость |
| Удельный вес | 1645 г/мл |
| Цвет | Бесцветный |
| Запах | Акко |
| Молярная масса | 153,33 г/моль |
| Плотность | 1645 г/мл |
| Точка плавления | -112,5°С |
| Точка кипения | 105,5°С |
| Мигающая точка | Непригодный |
| Растворимость в воде | Реагирует бурно |
| Растворимость | Растворим в органических растворителях, таких как бензол, четыреххлористый углерод и хлороформ. |
| Давление газа | 11 мм рт.ст. при 20°C |
| Плотность пара | 5,29 (Воздух = 1) |
| пКа | Непригодный |
| рН | Непригодный |
Безопасность и опасность хлорокиси фосфора
Фосфорилхлорид представляет угрозу безопасности и требует осторожного обращения. Разъедает кожу, глаза и дыхательную систему. Контакт может вызвать серьезные ожоги и повреждение глаз. Вдыхание его паров или паров может вызвать раздражение дыхательных путей. При работе с этим составом следует использовать соответствующие средства индивидуальной защиты, такие как перчатки и очки. Хранить его следует в хорошо проветриваемом помещении, вдали от источников возгорания. В случае воздействия необходима немедленная медицинская помощь. Кроме того, обращаться с ним необходимо под вытяжным шкафом, чтобы избежать выделения токсичных паров.
| Символы опасности | Коррозионное, Опасно |
| Описание безопасности | Коррозионный. Вызывает серьезные ожоги кожи и повреждения глаз. Может быть вредным при вдыхании или проглатывании. Избегайте контакта и вдыхания. |
| Идентификационные номера ООН | 1810 год |
| код ТН ВЭД | 2812.10.00 |
| Класс опасности | Класс 8 (коррозионные вещества) |
| Группа упаковки | Группа упаковки III (незначительная опасность) |
| Токсичность | Фосфорилхлорид токсичен и может вызвать серьезные последствия для здоровья. |
Методы синтеза оксихлорида фосфора
Фосфорилхлорид можно синтезировать различными методами. Распространенный метод включает реакцию между трихлоридом фосфора (PCl3) и кислородом (O2). В этом процессе PCl3 нагревается в присутствии избытка кислорода с образованием хлористого фосфорила. Реакция является экзотермической и обычно протекает в контролируемой среде, например в корпусе реактора.
Другой метод синтеза включает реакцию пятиокиси фосфора (P2O5) и трихлорида фосфора. P2O5 действует как дегидратирующий агент и в сочетании с PCl3 образует фосфорилхлорид.
Кроме того, фосфорилхлорид можно синтезировать реакцией трибромида фосфора (PBr3) и пятиокиси фосфора. Эта реакция приводит к образованию хлористого фосфорила и пентабромида фосфора.
Кроме того, прямое хлорирование фосфора также может привести к образованию фосфорилхлорида. В этом процессе газообразный хлор проходит над нагретым фосфором, в результате чего образуется хлорид фосфорила.
Важно отметить, что эти синтетические методы следует применять с осторожностью из-за реакционной способности и опасной природы используемых соединений. Для обеспечения безопасного обращения и синтеза фосфорилхлорида необходимо соблюдать надлежащие протоколы безопасности, включая использование защитного оборудования и контролируемых условий реакции.
Использование оксихлорида фосфора
Фосфорилхлорид находит разнообразное применение в различных отраслях промышленности благодаря своим уникальным свойствам. Вот некоторые распространенные варианты использования:
- Химический синтез. В органической химии хлористый фосфорил широко используется в качестве универсального реагента для получения различных соединений, включая фосфоновые кислоты, сложные эфиры и амиды.
- Агрохимикаты. Синтез пестицидов и гербицидов для защиты растений и борьбы с вредителями связан с фосфорилхлоридом как ключевым ингредиентом, играющим решающую роль.
- Фармацевтическая промышленность: при производстве фармацевтических промежуточных продуктов и активных фармацевтических ингредиентов (АФИ) используется фосфорилхлорид, что облегчает синтез важных лекарств, таких как противомалярийные и противовоспалительные препараты.
- Полимерная промышленность: В производстве полимеров хлористый фосфорил выступает в качестве катализатора и хлорирующего агента, способствуя синтезу антипиреновых добавок, повышающих огнестойкость материалов.
- Производство красителей и пигментов: Хлорид фосфорила находит применение в производстве красителей и пигментов, особенно при получении хлоралкилфосфонатов, соединений, необходимых для разработки красителей, используемых в текстиле, чернилах и покрытиях.
- Лабораторный реагент: В различных лабораторных процедурах в качестве реагента используется фосфорилхлорид, включая преобразование спиртов в алкилхлориды и приготовление фосфорилирующих агентов.
- Очистка воды. В процессах очистки воды хлористый фосфорил используется в качестве подкисляющего и дезинфицирующего агента для контроля уровня pH и удаления примесей.
- Антипирены: Фосфорилхлорид играет роль в производстве огнезащитных материалов, улучшая огнезащитные свойства текстиля, пластмасс и строительных материалов.
Эти разнообразные применения демонстрируют важность фосфорилхлорида во многих отраслях промышленности, подчеркивая его решающую роль в химическом синтезе, сельском хозяйстве, фармацевтике и материаловедении.
Вопросы
Вопрос: Какова молекулярная геометрия POCl3?
A: Молекулярная геометрия POCl3 является тригонально-пирамидальной.
Вопрос: Какой основной алкен образуется при дегидратации соединения А с помощью POCl3 и пиридина?
А: Основной алкен, образующийся при дегидратации соединения А с помощью POCl3 и пиридина, зависит от конкретного строения соединения А.
Вопрос: POCl3 полярный или неполярный?
Ответ: POCl3 является полярной молекулой из-за наличия полярных связей и асимметричной формы молекулы.
Вопрос: Сколько газа POCl3 можно произвести?
Ответ: Объем образующегося газа POCl3 зависит от количества реагентов и конкретных условий реакции.
Вопрос: Сколько молей POCl3 содержится в 10,0 граммах POCl3?
Ответ: В 10,0 граммах POCl3 содержится примерно 0,082 моля POCl3.
Вопрос: Какова геометрия электронной пары P в POCl3?
A: Геометрия электронной пары P в POCl3 тетраэдрическая.
Вопрос: Есть ли у POCl3 дипольный момент?
Ответ: Да, POCl3 имеет дипольный момент из-за наличия полярных связей и геометрии молекулы.
Вопрос: Есть ли у POCl3 резонанс?
Ответ: Нет, POCl3 не проявляет резонанса, поскольку в нем нет делокализованных электронов или множественных резонансных структур.
Вопрос: Какова геометрия электронного домена вокруг атома кислорода в POCl3?
A: Геометрия электронного домена вокруг атома кислорода в POCl3 тригонально-пирамидальная.
Вопрос: Какой объем H3PO4 образуется при полной реакции 72,3 миллилитра POCl3?
Ответ: Объем H3PO4, образующийся при реакции 72,3 миллилитра POCl3, полностью зависит от стехиометрии реакции и не может быть определен на основании только предоставленной информации.
