Цианистый водород — высокотоксичное соединение, используемое в промышленности, известное своим смертельным воздействием на дыхательную систему. Он бесцветен, имеет характерный запах и представляет значительную опасность для здоровья человека.
| Название ИЮПАК | Цианистый водород |
| Молекулярная формула | HCN |
| Количество CAS | 74-90-8 |
| Синонимы | Синильная кислота, Формонитрил, Синильная кислота, Синильная кислота |
| ИнЧИ | ИнЧИ=1С/ЧН/c1-2/h1H |
Свойства цианистого водорода
Формула цианида водорода
Формула синильной кислоты: HCN. Он состоит из атома водорода (H), связанного с атомом углерода (C) посредством тройной связи, а атом углерода дополнительно связан с атомом азота (N). Эта простая молекулярная формула представляет собой состав синильной кислоты.
Цианид водорода Молярная масса
Молярная масса синильной кислоты составляет примерно 27,03 грамма на моль. Его рассчитывают путем сложения атомных масс водорода (H), углерода (C) и азота (N), присутствующих в молекуле синильной кислоты.
Температура кипения цианистого водорода
Цианид водорода имеет температуру кипения около 25,7 градусов по Цельсию (78,3 градуса по Фаренгейту). При этой температуре синильная кислота переходит из жидкого состояния в газообразное, выделяя токсичные пары.
Температура плавления цианистого водорода
Температура плавления синильной кислоты составляет примерно -13,4 градуса Цельсия (7,9 градуса по Фаренгейту). При этой температуре синильная кислота переходит из твердого состояния в жидкое.
Плотность цианистого водорода г/мл
Плотность синильной кислоты составляет примерно 0,687 грамма на миллилитр. Это значение плотности представляет собой массу синильной кислоты на единицу объема.
Цианистый водород Молекулярный вес
Молекулярная масса синильной кислоты составляет примерно 27,03 грамма на моль. Он определяется путем сложения атомных весов составляющих его элементов.
Структура цианида водорода
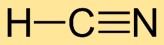
Цианистый водород имеет линейную молекулярную структуру, в которой атом водорода (H) связан с атомом углерода (C), а атом углерода (C) связан с атомом азота (N). Тройная связь между углеродом и азотом придает молекуле стабильность.
Растворимость цианистого водорода
Синильная кислота хорошо растворима в воде. Легко растворяется в воде, образуя бесцветный раствор. Эта растворимость позволяет синильной кислоте легко смешиваться и взаимодействовать с другими веществами в различных приложениях и средах.
| Появление | Бесцветный газ |
| Удельный вес | 0,687 |
| Цвет | Бесцветный |
| Запах | Отчетливый запах |
| Молярная масса | 27,03 г/моль |
| Плотность | 0,687 г/мл |
| Точка плавления | -13,4°C (-7,9°F) |
| Точка кипения | 25,7°С (78,3°Ф) |
| Мигающая точка | -17,8°С (0°Ф) |
| Растворимость в воде | Смешивается с водой |
| Растворимость | Растворим в органических растворителях, таких как эфир и этиловый спирт. |
| Давление газа | 500 мм рт.ст. при 20°C |
| Плотность пара | 0,95 |
| пКа | 9.3 |
| рН | 5,6 (разбавленная синильная кислота) |
Безопасность и опасности цианида водорода
Цианистый водород представляет значительную угрозу безопасности, и с ним следует обращаться с особой осторожностью. Он очень токсичен при вдыхании, проглатывании или проникновении через кожу. Воздействие синильной кислоты может вызвать тяжелую дыхательную недостаточность, остановку сердца и даже смерть. Важно обеспечить достаточную вентиляцию и использовать средства индивидуальной защиты при работе с синильной кислотой или рядом с ней. Кроме того, соединение огнеопасно и может образовывать взрывоопасные смеси с воздухом. Хранение следует осуществлять в плотно закрытой таре, вдали от источников возгорания. Для снижения рисков, связанных с воздействием синильной кислоты, должны быть приняты экстренные протоколы, такие как оказание неотложной медицинской помощи и эвакуация пострадавших районов.
| Символы опасности | Череп и кости |
| Описание безопасности | Очень токсичен; обращаться с особой осторожностью |
| Идентификационные номера ООН | UN1051 (цианистоводородная кислота) |
| код ТН ВЭД | 2811.11.00 |
| Класс опасности | 6.1 (Токсичные вещества) |
| Группа упаковки | Я (Большая опасность) |
| Токсичность | Чрезвычайно токсичен; может быть смертельным даже в небольших количествах |
Методы синтеза цианида водорода
Синильную кислоту можно синтезировать различными методами.
Распространенным методом является процесс Андруссова. В этом процессе платиновые или родиевые катализаторы облегчают реакцию аммиака (NH₃) и метана (CH₄) с кислородом (O₂) с образованием синильной кислоты. Реакция протекает при высоких температурах, обычно от 1000 до 1200°C. Метан действует как восстановитель, превращая кислород в воду (H₂O), а аммиак является источником азота. Полученная смесь претерпевает ряд реакций, приводящих к образованию синильной кислоты (HCN) и водяного пара.
Другим методом синтеза синильной кислоты является процесс БМА. Это включает реакцию метана (CH₄) с аммиаком (NH₃) в присутствии катализатора, такого как медь или никель, при высокой температуре. В этом процессе образуется синильная кислота и другие побочные продукты.
Процесс Андруссова-Ноддака производит синильную кислоту путем реакции цианида натрия (NaCN) с сильной кислотой, такой как серная кислота (H₂SO₄).
Стоит отметить, что синильная кислота является высокотоксичным соединением, и ее синтез необходимо проводить с большой осторожностью в хорошо оборудованных помещениях с соблюдением соответствующих протоколов безопасности. Использование специального оборудования, адекватная вентиляция и соблюдение инструкций по технике безопасности необходимы для обеспечения благополучия персонала, участвующего в процессе синтеза.
Использование цианида водорода
Цианистый водород находит применение в различных отраслях промышленности благодаря своим уникальным свойствам. Вот некоторые из его применений:
- Химическое производство: синильная кислота играет решающую роль в синтезе нескольких важных химических веществ, включая адипонитрил (ключевой компонент в производстве нейлона), метилметакрилат (используется для акриловых пластмасс) и цианид натрия (используется в добыче золота).
- Фармацевтика: Производство фармацевтических препаратов, таких как витамины, синтетические аминокислоты и некоторые антибиотики, основано на синильной кислоте.
- Фумигация. Промышленность использует синильную кислоту в качестве фумиганта для борьбы с вредителями, особенно в закрытых помещениях, таких как теплицы, корабельные трюмы и хранилища зерна.
- Металлическое покрытие. Металлургическая промышленность использует синильную кислоту в процессах гальваники, чтобы создать защитный слой на металлических поверхностях.
- Производство полимеров: Цианистый водород активно участвует в производстве синтетических волокон, каучуков и смол.
- Инсектициды: некоторые инсектициды содержат активные ингредиенты, полученные из синильной кислоты, которые обеспечивают эффективную борьбу с вредителями в сельском и лесном хозяйстве.
- Лабораторный реагент: Цианистый водород служит реагентом в различных химических реакциях и лабораторных процедурах.
- Горное дело: при добыче золота и серебра синильная кислота действует как химический реагент для извлечения драгоценных металлов из руд.
- Производство синтетического каучука: Цианистый водород служит сырьем при производстве синтетического каучука, например бутадиен-стирольного каучука (SBR).
- Красители и пигменты. При производстве красителей и пигментов используется синильная кислота, придающая им красящие свойства.
Хотя синильная кислота имеет свое применение, важно обращаться с ней с большой осторожностью из-за ее высокой токсичности. Строгие протоколы безопасности и соблюдение правильных процедур обращения необходимы для минимизации рисков, связанных с его использованием.
Вопросы:
Вопрос: Для чего используется цианистый водород?
Ответ: Цианистый водород используется в химическом производстве, фармацевтическом производстве, фумигации, металлизации, инсектицидах, а также в качестве лабораторного реагента и в других областях.
Вопрос: Какова химическая формула цианида водорода?
Ответ: Химическая формула синильной кислоты — HCN.
Вопрос: Каковы «разрешенные виды использования» цианистого водорода?
Ответ: «Разрешенные цели» HCN включают его одобренное и регулируемое использование в конкретных промышленных процессах, исследованиях и других разрешенных применениях.
Вопрос: В чем содержится цианистый водород?
Ответ: Цианистый водород можно найти в различных химикатах, промышленных условиях и природных источниках, таких как некоторые растения и семена.
Вопрос: Где можно купить цианистый водород?
Ответ: Покупка цианистого водорода строго ограничена и регулируется из-за его токсичности и потенциального неправильного использования.
Вопрос: Что такое цианистый водород?
Ответ: Цианистый водород — высокотоксичное и летучее соединение с характерным запахом, обычно используемое в промышленных процессах.
Вопрос: Цианистый водород полярный или неполярный?
Ответ: Цианистый водород является полярной молекулой из-за наличия полярных связей и асимметричного распределения электронной плотности.
Вопрос: Какое слово или фраза из двух слов лучше всего описывает форму молекулы цианида водорода (HCN)?
Ответ: Форма молекулы HCN линейная.
Вопрос: Для чего используется цианистый водород?
Ответ: Цианид водорода используется в различных отраслях промышленности для химического синтеза, фумигации, металлизации, инсектицидов и фармацевтического производства.
Вопрос: Использовался ли цианистый водород при террористической атаке?
Ответ: Да, в прошлом HCN использовался в качестве химического оружия при террористических атаках.
Вопрос: Какие еще химические названия связаны с цианистым водородом?
Ответ: Другие химические названия, связанные с HCN, включают синильную кислоту, формонитрил, синильную кислоту и синильную кислоту.
Вопрос: Какова правильная точечная диаграмма Льюиса для цианида водорода?
A: Правильная точечная диаграмма Льюиса для HCN включает атом водорода (H), связанный с атомом углерода (C) посредством одинарной связи, и атом углерода (C), связанный с атомом азота (N) тройной связью.
Вопрос: Каков заряд атомов цианистого водорода?
Ответ: В HCN атом водорода (H) имеет положительный частичный заряд, атом углерода (C) имеет отрицательный частичный заряд, а атом азота (N) имеет отрицательный частичный заряд.
Вопрос: Что на вас делает капсула с цианистым водородом?
Ответ: В условиях жесткого регулирования и контроля капсула HCN может использоваться как быстрое и смертоносное средство самостоятельного введения, обычно в тайных или экстренных целях.
Вопрос: Какой тип связи представляет собой связь углерод-азот в молекуле цианида водорода (HCN)?
Ответ: Связь углерод-азот в молекуле HCN является тройной связью.
