Гидроксид железа(III) – соединение, образующееся в результате реакции железа с водой. Он широко используется в фармацевтике, при очистке воды и в качестве пигмента в красках.
| Название ИЮПАК | Гидроксид железа(III) |
| Молекулярная формула | Fe(OH)₃ |
| Количество CAS | 20344-49-4 |
| Синонимы | Гидроксид железа, тригидроксид железа, гидрат железа, оксигидроксид железа (III) |
| ИнЧИ | InChI=1S/Fe.3H2O/h;3*1H2/q+3;;;/p-3 |
Свойства гидроксида железа(III)
Формула гидроксида железа(III)
Формула гидроксида железа(III) Fe(OH)₃. Это указывает на то, что каждая молекула Fe(OH)₃ состоит из одного атома Fe, связанного с тремя ионами OH.
Гидроксид железа(III) Молярная масса
Молярную массу Fe(OH)₃ можно рассчитать, сложив атомные массы составляющих его элементов. Молярная масса железа составляет 55,845 г/моль, а молярная масса каждого иона гидроксида (ОН) составляет 17,007 г/моль. Следовательно, молярная масса Fe(OH)₃ составляет примерно 106,867 г/моль.
Температура кипения гидроксида железа(III)
Fe(OH)₃ не имеет четко определенной точки кипения, поскольку он разлагается, не достигнув точки кипения. Вместо этого он подвергается термическому разложению с образованием оксида железа (III) и воды при нагревании.
Температура плавления гидроксида железа(III)
Fe(OH)₃ также разлагается при нагревании и не имеет четко выраженной температуры плавления. При высоких температурах он превращается в оксид железа (III) и воду.
Плотность гидроксида железа (III), г/мл
Плотность Fe(OH)₃ зависит от различных факторов, таких как его физическое состояние (твердое тело или раствор) и его концентрация. Плотность твердой формы Fe(OH)₃ составляет примерно 3,4 г/мл.
Гидроксид железа(III) Молекулярный вес
Молекулярная масса Fe(OH)₃ рассчитывается путем сложения атомных масс составляющих его атомов. Молекулярная масса Fe(OH)₃ составляет примерно 106,867 г/моль.
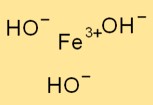
Строение гидроксида железа(III)
Fe(OH)₃ имеет тригональную структуру, в которой атом железа окружен тремя ионами гидроксида. Атом железа действует как центральный атом, и ионы гидроксида связаны с ним ионными связями.
Растворимость гидроксида железа(III)
Fe(OH)₃ имеет ограниченную растворимость в воде. При растворении в воде он образует осадок, и его растворимость зависит от различных факторов, таких как температура, pH и присутствие других ионов. Растворимость Fe(OH)₃ увеличивается в кислой среде.
| Появление | Сплошной коричневый |
| Удельный вес | 3.4 |
| Цвет | Коричневый |
| Запах | Без запаха |
| Молярная масса | 106 867 г/моль |
| Плотность | 3,4 г/мл |
| Точка плавления | Разложившийся |
| Точка кипения | Разложившийся |
| Мигающая точка | Непригодный |
| Растворимость в воде | нерастворимый |
| Растворимость | Нерастворимый. Зависит от таких факторов, как температура, pH и присутствие других ионов. |
| Давление газа | Незначительный |
| Плотность пара | Непригодный |
| пКа | Непригодный |
| рН | Около 5-7 |
Безопасность и опасность гидроксида железа (III)
Fe(OH)₃ представляет определенные проблемы безопасности и опасности. Обычно считается, что он имеет низкую токсичность. Однако проглатывание или вдыхание больших количеств может вызвать раздражение желудочно-кишечного тракта и респираторный дискомфорт. Важно избегать попадания средства в глаза и на кожу, так как это может вызвать раздражение. В случае попадания промыть пораженные участки большим количеством воды. При работе с Fe(OH)₃ рекомендуется носить соответствующие защитные средства, такие как перчатки и очки, чтобы свести к минимуму риск воздействия. Необходимо обеспечить достаточную вентиляцию, чтобы избежать скопления пыли. Кроме того, важно соблюдать меры предосторожности и обращаться с Fe(OH)₃ с осторожностью, чтобы свести к минимуму потенциальные риски.
| Символы опасности | Никто |
| Описание безопасности | – Избегайте контакта с глазами и кожей <br> – Используйте защитное оборудование <br> – Обеспечьте достаточную вентиляцию. |
| Идентификационные номера ООН | Непригодный |
| код ТН ВЭД | 2821.10.0000 |
| Класс опасности | Неклассифицированный |
| Группа упаковки | Непригодный |
| Токсичность | Низкая токсичность |
Методы синтеза гидроксида железа (III)
Существуют разные методы синтеза Fe(OH)₃. Обычно используемый метод включает реакцию осаждения между солью железа и основанием. Например, при добавлении раствора хлорида железа (FeCl₃) к раствору гидроксида натрия (NaOH) может образоваться Fe(OH)₃. Реакция происходит следующим образом:
FeCl₃ + 3NaOH → Fe(OH)₃ + 3NaCl
Другим методом гидроксид железа(II) можно окислить до Fe(OH)₃, подвергая его воздействию воздуха или обрабатывая окислителем. Реакция происходит следующим образом:
4Fe(OH)₂ + O₂ → 2Fe(OH)₃
Кроме того, Fe(OH)₃ можно получить гидролизом раствора соли железа. Этот процесс включает добавление воды к раствору соли железа, в результате чего образуется осадок Fe(OH)₃. Реакция происходит следующим образом:
FeCl₃ + 3H₂O → Fe(OH)₃ + 3HCl
Эти методы синтеза позволяют получить Fe(OH)₃ для различных применений, включая фармацевтику, очистку воды и в качестве пигмента в красках. Важно соблюдать надлежащие меры предосторожности и ответственно обращаться с химикатами в процессе синтеза.
Использование гидроксида железа(III)
Fe(OH)₃ имеет несколько применений благодаря своим уникальным свойствам. Вот некоторые распространенные варианты использования Fe(OH)₃:
- Фармацевтическая промышленность. Фармацевтическая промышленность использует Fe(OH)₃ при производстве железосодержащих добавок и лекарств, например, тех, которые используются для лечения железодефицитной анемии.
- Очистка воды: В процессах очистки воды используется Fe(OH)₃ для удаления загрязнений и примесей. Fe(OH)₃ действует как флокулянт, помогая агломерировать и удалять взвешенные частицы в воде.
- Пигмент в красках: Fe(OH)₃ коричневого цвета находит применение в качестве пигмента в красках, покрытиях и красителях. Он придает ряд землистых тонов и особенно полезен для получения цветов охры и сиены.
- Очистка сточных вод: На очистных сооружениях используется Fe(OH)₃ для удаления фосфатов и примесей тяжелых металлов из промышленных сточных вод.
- Катализ: Fe(OH)₃ действует как катализатор в различных химических реакциях, включая разложение перекиси водорода и реакции окисления.
- Адсорбент: Fe(OH)₃ служит адсорбентом для удаления примесей, загрязнений и красителей из растворов.
- Улучшитель почвы: Fe(OH)₃ действует как добавка к почве, улучшая плодородие почвы и доступность питательных веществ. Он улучшает способность почвы удерживать питательные вещества и обеспечивает необходимое железо для роста растений.
- Лабораторный реагент: В лаборатории исследователи и аналитики используют Fe(OH)₃ в качестве реагента для различных аналитических и исследовательских целей, включая реакции осаждения и корректировку pH.
Универсальное применение Fe(OH)₃ подчеркивает его важность в различных отраслях промышленности и его вклад в различные процессы, от фармацевтики до санитарии окружающей среды.
Вопросы:
Вопрос: Каков правильный вес формулы гидроксида железа (III)?
Ответ: Правильный формульный вес Fe(OH)₃ составляет примерно 106,867 г/моль.
Вопрос: Каково полное ионное уравнение реакции между FeBr3 и гидроксидом бария?
A: Полное ионное уравнение реакции FeBr3 с гидроксидом бария: FeBr₃ + 3Ba(OH)₂ → 3BaBr₂ + Fe(OH)₃.
Вопрос: Какую массу осадка гидроксида железа(III) можно получить при взаимодействии 75,0 мл?
Ответ: Для определения массы осадка Fe(OH)₃ необходима дополнительная информация, такая как концентрация или молярность реагентов.
Вопрос: Как получить гидроксид железа(III)?
Ответ: Fe(OH)₃ может образовываться различными методами, включая реакции осаждения между солями железа и основаниями, окисление Fe(OH)2 или гидролиз раствора солей железа.
Вопрос: Растворим ли гидроксид железа(III)?
О: Нет, Fe(OH)₃ не растворяется в воде. При растворении в воде образует осадок.
Вопрос: Сколько граммов Fe(OH)₃ содержится в 4,61 граммах Fe³⁺?
A: Для определения граммов Fe(OH)₃ необходима молярная масса Fe³⁺ и стехиометрия реакции.
Вопрос: Какого цвета Fe(OH)₃?
Ответ: Fe(OH)₃ обычно имеет коричневый цвет.
Вопрос: Является ли гидроксид железа твердым веществом?
Ответ: Да, гидроксид железа существует в твердой форме.
Вопрос: Что получается при термическом разложении гидроксида железа?
A: При термическом разложении Fe(OH)₃ образуется оксид железа(III) (Fe₂O₃) и вода.
Вопрос: Растворяется ли гидроксид железа в воде?
Ответ: Нет, гидроксид железа не растворяется в воде. При смешивании с водой образует осадок.
