Нитрат железа III представляет собой химическое соединение. Он образуется путем соединения ионов железа с ионами нитрата. Он широко используется в промышленности и в качестве лабораторного реагента.
| Название ИЮПАК | Нитрат железа(III) |
| Молекулярная формула | Fe(NO3)3 |
| Количество CAS | 10421-48-4 |
| Синонимы | Нитрат железа, тринитрат железа, соль железа (III) азотной кислоты |
| ИнЧИ | InChI=1S/Fe.3NO3/c;3 2-1(3)4/q+3;3 -1 |
Свойства нитрата железа (III)
Формула нитрата железа(III)
Формула нитрата железа III: Fe(NO3)3. Он состоит из одного иона железа (Fe) и трех ионов нитрата (NO3). Эта формула представляет собой комбинацию катиона железа с нитрат-анионами.
Нитрат железа(III) Молярная масса
Молярную массу нитрата железа можно рассчитать, сложив атомные массы составляющих его элементов. Железо (Fe) имеет молярную массу 55,845 г/моль, а каждый нитрат-ион (NO3) имеет молярную массу 62,0049 г/моль. Сложение этих значений дает молярную массу нитрата железа примерно 241,86 г/моль.
Температура кипения нитрата железа(III)
Нитрат железа не имеет определенной температуры кипения. При нагревании он разлагается на различные оксиды азота и в конечном итоге образует оксид железа. Температура разложения зависит от таких факторов, как концентрация и присутствие других веществ.
Температура плавления нитрата железа(III)
Температура плавления нитрата железа составляет примерно 47°C (117°F). При этой температуре твердое соединение переходит в жидкое состояние. Важно отметить, что температура плавления может незначительно меняться в зависимости от таких факторов, как примеси или точный состав соединения.
Плотность нитратов железа(III), г/мл
Плотность Fe(NO3)3 составляет примерно 1,68 г/мл. Плотность представляет собой массу единицы объема вещества. В данном случае указывается масса Fe(NO3)3 на миллилитр соединения.
Нитрат железа(III) Молекулярный вес
Молекулярная масса нитрата железа составляет примерно 241,86 г/моль. Молекулярная масса относится к сумме атомных весов всех атомов в молекуле.
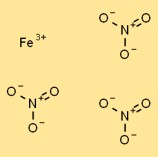
Структура нитрата железа(III)
Нитрат железа в твердой форме имеет кристаллическую структуру. Он состоит из катионов Fe3+, окруженных координированными нитрат-анионами (NO3-). Катионы железа удерживаются вместе ионными связями, а нитрат-анионы притягиваются к катионам электростатическими силами.
Растворимость нитратов железа(III)
Нитрат железа хорошо растворим в воде. Он легко растворяется в воде с образованием прозрачного бледно-желтого раствора. Растворимость нитрата железа в других растворителях или веществах может варьироваться.
| Появление | Бледно-желтые кристаллы |
| Удельный вес | 1,68 |
| Цвет | Бледно-желтый |
| Запах | Без запаха |
| Молярная масса | 241,86 г/моль |
| Плотность | 1,68 г/мл |
| Точка плавления | 47°С (117°Ф) |
| Точка кипения | Разложившийся |
| Мигающая точка | Непригодный |
| Растворимость в воде | Очень растворим |
| Растворимость | Растворим в воде и полярных растворителях. |
| Давление газа | Нет в наличии |
| Плотность пара | Нет в наличии |
| пКа | Нет в наличии |
| рН | Кислота |
Безопасность и опасность нитрата железа (III)
Нитрат железа представляет некоторую угрозу безопасности, поэтому при обращении с ним следует соблюдать осторожность. Считается раздражающим кожу, глаза и дыхательную систему. Следует избегать прямого контакта с составом и использовать защитные средства, такие как перчатки и очки. Проглатывание или вдыхание нитрата железа может вызвать вредные последствия, поэтому его нельзя проглатывать или вдыхать. Важно работать с этим составом в хорошо проветриваемом помещении, чтобы свести к минимуму риск вдыхания. В случае случайного воздействия или проглатывания следует немедленно обратиться за медицинской помощью. Для обеспечения безопасности необходимо соблюдать надлежащие методы хранения и обращения.
| Символы опасности | Си, О |
| Описание безопасности | Вызывает раздражение кожи и глаз. Может вызвать раздражение дыхательных путей. Вред при проглатывании. |
| Идентификационные номера ООН | ООН 1466 (Безводный) |
| код ТН ВЭД | 28342990 |
| Класс опасности | 5.1 (Окислитель) |
| Группа упаковки | II |
| Токсичность | Умеренная токсичность |
Методы синтеза нитрата железа(III)
Нитрат железа можно синтезировать различными методами, наиболее распространенным из которых является растворение оксида железа (III) (Fe2O3) в концентрированной азотной кислоте (HNO3). В результате этой реакции образуется нитрат железа, представленный уравнением:
Концентрированная азотная кислота растворяет оксид железа(III) с образованием Fe(NO3)3, а также воды:
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O.
Другой метод предполагает объединение металлического железа со смесью азотной кислоты и перекиси водорода, которая окисляет железо с образованием нитрата железа. Эта известная реакция заслуживает названия метода «царской водки».
Добавление металлического железа к смеси азотной кислоты и перекиси водорода приводит к образованию нитрата железа и воды:
2Fe + 8HNO3 + 6H2O2 → 2Fe(NO3)3 + 6H2O.
Крайне важно проявлять осторожность при проведении этих реакций из-за коррозионного и окислительного характера используемых химических веществ. Необходимо соблюдать надлежащие меры безопасности, такие как ношение защитной одежды и работа в хорошо проветриваемом помещении.
Авторитетные поставщики химикатов предлагают коммерчески доступный нитрат железа, гарантируя постоянный и надежный источник соединения для различных применений в промышленности и лабораториях.
Использование нитрата железа(III)
Нитрат железа имеет несколько практических применений в различных отраслях промышленности и лабораториях. Вот некоторые ключевые области применения нитрата железа:
- Промышленный катализатор. В некоторых промышленных процессах, включая производство нейлона и других полимеров, в качестве катализатора используется нитрат железа.
- Крашение и пигменты. В красильной и пигментной промышленности нитрат железа используется в качестве протравы для закрепления красителей на тканях и улучшения стойкости цвета.
- Травление. В металлообрабатывающей и электронной промышленности нитрат железа используется в качестве травителя для создания замысловатых узоров и рисунков на металлических поверхностях.
- Лабораторный реагент: Нитрат железа служит распространенным лабораторным реагентом для различных химических реакций и экспериментов, особенно для синтеза других соединений.
- Окислитель: Нитрат железа действует как окислитель в химических реакциях, включая органический синтез, благодаря своим сильным окислительным свойствам.
- Очистка воды: Нитрат железа используется в процессах очистки воды для удаления примесей, таких как фосфаты и сульфиды, из промышленных сточных вод.
- Фотография. В некоторых фотографических процессах, особенно при приготовлении фотоэмульсий на основе железа, используется нитрат железа.
- Аналитическая химия. Нитрат железа находит применение в методах аналитической химии, таких как колориметрический анализ, для обнаружения и количественного определения конкретных веществ.
- Консервация древесины: при консервации древесины в качестве активного ингредиента используется нитрат железа для защиты древесины от грибковой гнили и заражения насекомыми.
- Фармацевтическое применение. При изготовлении некоторых фармацевтических продуктов и лекарств используется нитрат железа.
Важно отметить, что при работе с нитратом железа следует соблюдать надлежащие правила обращения и меры предосторожности из-за его коррозионной и окислительной природы.
Вопросы:
Вопрос: Является ли нитрат железа(III) легковоспламеняющимся?
Ответ: Нет, нитрат железа не горюч.
Вопрос: Каковы проблемы безопасности и обращения с нитратом железа(III)?
Ответ: Проблемы безопасности включают раздражение кожи, глаз и дыхательных путей. Поэтому при обращении с ним необходимо использовать соответствующие защитные средства и меры предосторожности.
Вопрос: Какая формула представляет нитрат железа(III)?
Ответ: Формула нитрата железа: Fe(NO3)3.
Вопрос: Какова формула нитрата железа (III)?
Ответ: Формула нитрата железа(III) — Fe(NO3)3.
Вопрос: Какова молярная масса нитрата железа(III)?
A: Молярная масса Fe(NO3)3 составляет примерно 241,86 г/моль.
Вопрос: Растворяется ли гидроксид железа в воде?
Ответ: Гидроксид железа плохо растворяется в воде.
Вопрос: Реагирует ли он с нитратом железа(III)?
О: Нет, кальций (Ca) обычно не реагирует с Fe(NO3)3.
Вопрос: С какой частью аспирина реагирует нитрат железа(III)?
Ответ: Нитрат железа(III) реагирует с карбоксилатной группой (-COO-), присутствующей в молекуле аспирина.
Вопрос: Какова молекулярная масса нитрата железа (III)?
Ответ: Молекулярная масса Fe(NO3)3 составляет примерно 241,86 г/моль.
Вопрос: Реагирует ли Al с нитратом железа(III)?
Ответ: Да, алюминий (Al) может реагировать с Fe(NO3)3 с образованием нитрата алюминия и металлического железа.
Вопрос: Сколько молей нитрата растворено в 50,0 г воды в 3,80 М растворе нитрата железа(III)?
Ответ: Для определения молей нитрата необходим объем раствора, так как указаны только молярность и масса воды.
