2 Бутанон, также известный как метилэтилкетон или МЭК, представляет собой бесцветную легковоспламеняющуюся жидкость со сладким фруктовым запахом. Он широко используется в качестве растворителя в различных промышленных и бытовых целях.
| Название ИЮПАК | 2-бутанон |
| Молекулярная формула | C4H8O |
| Количество CAS | 78-93-3 |
| Синонимы | Метилэтилкетон (МЭК), бутан-2-он, 2-бутанон, 3-оксобутан-2-он |
| ИнЧИ | ИнЧИ=1S/C4H8O/c1-3-4-5-2/h3-4H,1-2H3 |
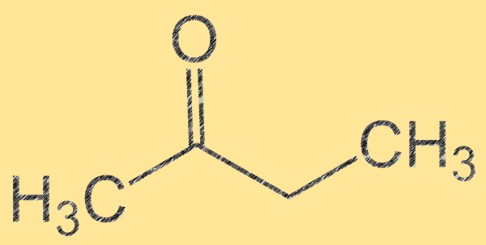
Структура бутанона
Бутанон имеет молекулярную формулу C4H8O, а его молекулярную структуру можно представить как CH3C(O)CH2CH3. Это бесцветная легковоспламеняющаяся жидкость со сладким фруктовым запахом. Бутанон представляет собой кетон, то есть он содержит карбонильную группу (C=O), присоединенную к атому углерода. Эта карбонильная группа делает бутанон важным промежуточным продуктом в синтезе различных органических соединений.
2-бутанон Молярная масса
Бутанон, также известный как метилэтилкетон (МЭК), имеет молярную массу 72,11 г/моль. Это количество вещества в данном образце бутанона, выраженное в граммах на моль. Молярная масса — важное свойство бутанона, которое используется в различных расчетах и экспериментах в химии, например, для определения массы вещества, необходимой для реакции с другим веществом в определенном молярном соотношении. Молярную массу бутанона также можно использовать для перевода его массы в моли, что полезно во многих приложениях, включая химические реакции, химический синтез и аналитическую химию.
Температура кипения МЕК
Температура кипения МЭК составляет 80,6°C (176,5°F). Это температура, при которой МЭК переходит из жидкого состояния в газообразное. Температура кипения является важным свойством МЭК, поскольку она влияет на его способность испаряться и образовывать пар. Например, в некоторых случаях МЭК используется в качестве растворителя, и желательно, чтобы он быстро испарялся, чтобы можно было удалить растворенное вещество. В других применениях желательно, чтобы МЕК оставался в жидкой форме, чтобы его можно было использовать в качестве растворителя для реакций, проводимых при температуре его кипения или ниже.
МЭК Точка плавления
Температура плавления МЭК составляет -93,9°C (-136,0°F). Это температура, при которой МЭК переходит из твердого состояния в жидкое. Температура плавления является важным свойством МЭК, поскольку она влияет на его способность использоваться в качестве растворителя твердых веществ. Например, МЭК можно использовать в качестве растворителя для некоторых твердых веществ, температура плавления которых ниже, чем его собственная температура плавления, таких как жиры, воски и смолы.
Плотность МЭК г/мл
Плотность МЭК составляет 0,80 г/мл. Это масса единицы объема МЭК, которая является важным свойством, используемым во многих приложениях, включая расчет количества МЭК, необходимого для определенного объема. Плотность МЭК также используется для расчета его молярного объема, который представляет собой объем, занимаемый одним молем МЭК. Эта информация полезна в различных экспериментах, в том числе при определении молярной массы вещества.
МЭК Молекулярный вес
Молекулярная масса МЭК составляет 72,11 г/моль. Это сумма атомных весов атомов в молекуле МЕК и важное свойство, используемое во многих приложениях, включая расчет молярной массы вещества. Молекулярную массу МЭК можно использовать для перевода его массы в моли, что полезно во многих приложениях, включая химические реакции, химический синтез и аналитическую химию.
формула МЕК
Химическая формула МЭК: C4H8O. Эта формула представляет относительные пропорции.
| Появление | Бесцветная жидкость |
| Удельный вес | 0,79 – 0,80 |
| Цвет | Бесцветный |
| Запах | Сладкий, фруктовый |
| Молярная масса | 72,11 г/моль |
| Плотность | 0,79 – 0,80 г/мл |
| Точка плавления | -93,9°C (-136,0°F) |
| Точка кипения | 80,6°С (176,5°Ф) |
| Мигающая точка | 12°С (53,6°Ф) |
| Растворимость в воде | Растворимый |
| Растворимость | Растворим в большинстве органических растворителей. |
| Давление газа | 38 мм рт.ст. (20°С) |
| Плотность пара | 2,3 (воздух = 1) |
| пКа | 20.2 |
| рН | 7 (нейтральный) |
Примечание. Значения, приведенные в этой таблице, являются приблизительными и могут незначительно отличаться в зависимости от источника и условий измерения.
Безопасность и опасность бутанона
Бутанон, также известный как метилэтилкетон, представляет собой легковоспламеняющуюся и летучую жидкость, которая может вызвать раздражение кожи, глаз и дыхательных путей, если с ней не соблюдать надлежащие меры предосторожности. Вдыхание высоких концентраций бутанона может вызвать головную боль, головокружение, тошноту и потерю сознания. Длительное воздействие низких концентраций бутанона может вызвать повреждение почек и печени. Он также легко воспламеняется и может легко воспламениться, создавая опасность пожара. При использовании бутанона важно работать в хорошо проветриваемом помещении, носить защитную одежду и очки, избегать контакта с кожей. При попадании на кожу или в глаза немедленно промыть водой и при необходимости обратиться к врачу. При проглатывании не вызывайте рвоту и немедленно обратитесь за медицинской помощью. Бутанон следует хранить в прохладном, сухом, хорошо проветриваемом месте, вдали от источников тепла и огня.
| Символы опасности | Легковоспламеняющаяся жидкость, Раздражающее вещество |
| Описание безопасности | S2 – Хранить в недоступном для детей месте<br>S16 – Хранить вдали от источников возгорания<br>S24/25 – Избегать попадания на кожу и в глаза<br>S26 – При попадании в глаза немедленно промыть большим количеством воды. и обратитесь за медицинской помощью |
| Идентификаторы сети | ООН1090 |
| код ТН ВЭД | 29141100 |
| Класс опасности | 3 (Горючая жидкость) |
| Группа упаковки | II |
| Токсичность | LD50 (перорально, крыса) – 4220 мг/кг |
Методы синтеза бутанона
Бутанон можно синтезировать несколькими методами, включая прямое окисление 2-бутанола и альдольную конденсацию ацетона и 2-пропанола.
Метод прямого окисления включает реакцию 2-бутанола с окислителем, таким как хромовая кислота, перекись водорода или смесь азотной и серной кислот. Реакция протекает в кислой среде и полученный метилэтилкетон отделяют от реакционной смеси перегонкой.
Метод альдольной конденсации включает реакцию ацетона с 2-пропанолом в присутствии сильного основания, такого как гидроксид натрия или гидроксид калия. В результате реакции образуется смесь метилэтилкетона и других побочных продуктов, которые отделяют перегонкой.
Другой метод синтеза включает реакцию ацетона с формальдегидом в присутствии катализатора, такого как серная кислота или п-толуолсульфокислота. В результате этой реакции образуется смесь метилэтилкетона, формальдегида и других побочных продуктов, которые отделяются перегонкой.
В целом, синтез метилэтилкетона требует тщательного контроля условий реакции, чтобы обеспечить получение высококачественного продукта с минимальным количеством побочных продуктов. Важно соблюдать надлежащие меры безопасности при работе с химическими веществами и реакциями, участвующими в синтезе метилэтилкетона.
Использование бутанона
Бутанон, также известный как метилэтилкетон, имеет широкий спектр промышленного применения благодаря своей растворимости, летучести и низкой температуре кипения. Некоторые из наиболее распространенных применений бутанона включают:
- Растворитель: Метилэтилкетон используется в качестве растворителя для различных веществ, таких как смолы, клеи, чернила, средства для снятия краски, печатные краски, нитроцеллюлозные лаки и синтетические каучуки.
- Чистящее средство. В электронной промышленности его используют в качестве чистящего средства для очистки металлических деталей и поверхностей от жира, масла и других загрязнений.
- Фармацевтика: В фармацевтической промышленности метилэтилкетон используется в качестве растворителя при производстве вакцин, антибиотиков и других лекарств.
- Покрытия: В покрытиях для дерева, бумаги и других материалов также используется метилэтилкетон в качестве растворителя при их производстве, а также при изготовлении лаков, лаков и других защитных покрытий.
- Парфюмерия: косметическая и пищевая промышленность используют метилэтилкетон в качестве растворителя для духов и ароматизаторов.
- Клеи. При производстве клеев и герметиков в качестве растворителя также используется метилэтилкетон.
Помимо промышленного использования, метилэтилкетон также изучался на предмет его потенциала в качестве топлива. Его высокое энергосодержание и низкая токсичность по сравнению с другими видами топлива делают его перспективным альтернативным источником энергии.
Вопросы:
Что даст следующая реакция? 2-бутанон + катализатор h2/ni
Реакция 2-бутанона с газообразным водородом на никелевом катализаторе известна как реакция гидрирования. Эта реакция даст следующий продукт:
2-бутанон + H2 -> 2-бутанол
Восстановление двойной связи между атомами углерода и кислорода в кетоновой группе 2-бутанона приводит к образованию 2-бутанола путем активации газообразного водорода никелевым катализатором. Химическая промышленность обычно использует эту реакцию для производства 2-бутанола, ценного растворителя и сырья для других химических производств. Тщательный контроль температуры, давления и типа катализатора необходим для эффективного и селективного гидрирования 2-бутанона в 2-бутанол.
Бутанон-2 – это кетон?
Органическая химия характеризует 2-бутанон, также известный как метилэтилкетон, как тип кетона с карбонильной группой (C=O), связанной с атомом углерода в углеводородной цепи. Карбонильная группа 2-бутанона расположена между двумя атомами углерода, отсюда и название «метилэтилкетон».
Каков инфракрасный спектр 2-бутанона?
ИК (инфракрасный) спектр 2-бутанона (также известного как метилэтилкетон) может предоставить важную информацию о его молекулярной структуре и функциональных группах. В ИК-спектре 2-бутанона обычно наблюдаются следующие основные полосы поглощения:
- Карбонильное растяжение: эта полоса проявляется в виде резкого пика между 1700 и 1700 см^-1 и характерна для функциональной группы C=O кетона.
- Алкильное растяжение: Пики между 2900 и 3000 см^-1 соответствуют валентным колебаниям групп CH2 и CH3 в 2-бутаноне.
- Изгиб CH: Пики между 1400 и 1500 см^-1 соответствуют деформационным колебаниям связей CH в 2-бутаноне.
- Изгиб COC: Пик между 1300 и 1400 см^-1 соответствует деформационным колебаниям группы COC в 2-бутаноне.
Важно отметить, что на ИК-спектр 2-бутанона будут влиять подготовка проб и используемые инструменты, а также наличие примесей или загрязняющих веществ.
