Этилен, также известный как этилен, представляет собой бесцветный легковоспламеняющийся газ со сладким запахом. Это важная часть химической промышленности, используемая при производстве пластмасс, растворителей и других химикатов.
| Название ИЮПАК | Этен |
| Молекулярная формула | C2H4 |
| Количество CAS | 74-85-1 |
| Синонимы | Этилен, Этен (ошибка), Олеифицирующий газ, Элайл, 1,2-Дигидроэтилен. |
| ИнЧИ | ИнЧИ=1S/C2H4/c1-2/h1-2H2 |
Формула этилена
Химическая формула этилена: C2H4. Он представляет количество и тип атомов, присутствующих в молекуле этилена. Формула используется в химических реакциях и расчетах с участием этилена, например, для определения стехиометрии реакции или количества этилена, необходимого для конкретного промышленного процесса.
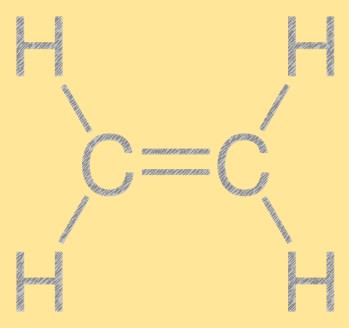
Структура этилена
Этилен имеет простую линейную структуру: два атома углерода, соединенные двойной связью, и четыре атома водорода, присоединенные к каждому атому углерода. Двойная связь углерод-углерод отвечает за реакционную способность этилена, что делает его полезным строительным блоком в химической промышленности. Молекула имеет плоскую структуру, все атомы которой лежат в одной плоскости.
Этен Молярная масса
Молярная масса этилена, также называемого этиленом, составляет 28,05 г/моль. Это простая органическая молекула, состоящая из двух атомов углерода и четырех атомов водорода, представленная химической формулой C2H4. Молярная масса рассчитывается путем сложения атомных масс отдельных атомов молекулы.
Молярная масса является важным параметром в химических реакциях и расчетах с участием этилена. Он используется для определения количества этилена, необходимого для реакции, а также количества продуктов, которые можно получить.
Температура кипения этилена
Температура кипения этилена составляет -103,7°C (-154,7°F). Этилен представляет собой газ при комнатной температуре и давлении, и его точка кипения намного ниже, чем у воды, что облегчает отделение его от других веществ в промышленных процессах.
Температура кипения этилена зависит от давления и чистоты образца. При более высоких давлениях температура кипения этилена увеличивается. Аналогично, примеси, присутствующие в образце, могут привести к отклонению температуры кипения от ожидаемого значения.
Температура плавления этилена
Температура плавления этилена составляет -169,2°C (-272,6°F). Этилен представляет собой неполярную молекулу линейной формы, что делает его относительно простой молекулой по сравнению со многими другими органическими соединениями. Это отражается на его низкой температуре плавления.
Как и температура кипения, температура плавления этилена может варьироваться в зависимости от чистоты образца. Примеси могут снизить температуру плавления и затруднить получение чистого образца для экспериментальных целей.
Плотность этилена г/мл
Плотность этилена составляет 0,958 г/мл при стандартных условиях температуры и давления (STP), определяемых как 0°C (32°F) и давление 1 атм. Этилен менее плотен, чем воздух, а это означает, что он может подниматься и рассеиваться в атмосфере.
Плотность является важным физическим свойством этилена, поскольку она используется в промышленных процессах для определения количества этилена, необходимого для данного объема пространства. Он также используется для расчета массы этилена в образце.
Молекулярный вес этилена
Молекулярная масса этилена составляет 28,05 г/моль. Это сумма атомных весов атомов, составляющих молекулу. Молекулярная масса является важным параметром во многих химических расчетах, особенно при определении стехиометрии реакции и количества необходимых или произведенных реагентов и продуктов.
| Появление | Бесцветный газ |
| Удельная плотность | 0,968 г/мл при 20°C (68°F) |
| Цвет | Бесцветный |
| Запах | Сладкий, пряный |
| Молярная масса | 28,05 г/моль |
| Плотность | 0,958 г/мл при 0°C и 1 атм. |
| Точка плавления | -169,2°C (-272,6°F) |
| Точка кипения | -103,7°C (-154,7°F) при давлении 1 атм. |
| Мигающая точка | -136°С (-213°Ф) |
| Растворимость в воде | 3,5 г/л при 25°C (77°F) |
| Растворимость | Нерастворим в воде, растворим в органических растворителях. |
| Давление газа | 114,6 кПа при 20°C (68°F) |
| Плотность пара | 0,97 (воздух = 1) |
| пКа | 44 |
| рН | Неприменимо, поскольку этилен не является водным раствором. |
Безопасность и опасности этилена
Этилен — легковоспламеняющийся газ, способный образовывать взрывоопасные смеси с воздухом. Он может самопроизвольно воспламениться на воздухе, если концентрация достаточно высока. Этилен также является удушающим веществом и может вытеснять кислород в замкнутых пространствах, создавая ужасающую опасность.
Контакт с жидким этиленом или воздействие высоких концентраций газа может привести к обморожению или ожогам. Этилен не токсичен, но продукты его сгорания, в том числе окись и углекислый газ, могут быть опасны для здоровья человека.
Обращение с этиленом требует соответствующих мер безопасности, включая достаточную вентиляцию, средства индивидуальной защиты и меры пожарной безопасности. Этилен следует хранить и транспортировать в хорошо проветриваемых помещениях, вдали от источников возгорания.
| Символы опасности | Горючий газ (GHS02), простой удушающий газ (GHS09) |
| Описание безопасности | Хранить вдали от источников возгорания – Не курить. Используйте только искробезопасные инструменты. Не вдыхайте газ. Используйте только на открытом воздухе или в хорошо проветриваемом помещении. Надевайте защитные перчатки/защитную одежду/защиту глаз/лица. |
| Идентификационные номера ООН | ООН 1962 (сжатый газ) |
| код ТН ВЭД | 2901.21.00 |
| Класс опасности | 2.1 (горючий газ) |
| Группа упаковки | Н/Д |
| Токсичность | Нетоксичный |
Методы синтеза этилена
Для синтеза этилена можно использовать различные методы, включая термический крекинг углеводородов и дегидратацию спиртов.
При термическом крекинге процесс включает нагревание углеводородов, таких как метан, пропан и нафта, при высоких температурах (от 500 до 900 ° C) в присутствии катализатора для расщепления длинноцепочечных молекул на более мелкие молекулы с образованием этилена. продукты.
Другим распространенным методом является дегидратация спирта, которая включает использование катализатора, такого как оксид алюминия или кремнезем, при высоких температурах (250–350°C) для дегидратации этанола или других спиртов и образования этилена и воды.
Паровой крекинг — это еще один процесс, используемый для производства этилена, при котором пар добавляется к углеводородам при высоких температурах (700–900°C) для образования смеси этилена и других продуктов.
Термическое разложение органических материалов, таких как древесина, бумага и пластик, также может привести к образованию этилена.
Другие методы синтеза этилена включают окислительное дегидрирование этана и процесс превращения метанола в олефины.
Использование этилена
Этилен – важный промышленный химикат, имеющий широкий спектр применения.
- Этилен играет решающую роль в производстве полиэтилена, одного из наиболее широко используемых пластиков в мире. Люди используют полиэтилен в различных целях, таких как упаковка, трубы и строительные материалы.
- Производители используют этилен в качестве ключевого ингредиента при производстве других полимеров, таких как поливинилхлорид (ПВХ). ПВХ используется в строительных материалах, медицинских приборах и электрических кабелях.
- Этилен также имеет решающее значение в производстве оксида этилена, важного сырья при производстве моющих средств, растворителей и пластмасс.
- Производители используют этилен для производства этиленгликоля, охлаждающей жидкости и антифриза для двигателей. Он также является сырьем для производства полиэфирных волокон, пленок и смол.
- Этилен используется в качестве топлива при сварке и резке металлов. Он также действует как агент созревания фруктов и овощей.
- Этилен полезен в синтезе различных органических соединений, включая этанол и ацетальдегид.
В целом, универсальность этилена делает его важным компонентом в широком спектре промышленных процессов, внося свой вклад во многие аспекты современной жизни.
Вопросы:
Какие диены вступят в реакцию с этиленом в реакции Дильса-Альдера?
Любой диен, содержащий две сопряженные двойные связи, может вступать в реакцию Дильса-Альдера с этиленом. Примеры таких диенов включают 1,3-бутадиен и изопрен.
Как расположены атомы водорода в этилене?
В этилене два атома углерода связаны друг с другом двойной связью. Каждый атом углерода также связан с двумя атомами водорода, а остальные валентности заняты двумя неподеленными парами электронов на каждом атоме углерода. Расположение атомов вокруг каждого углерода тригональное.
Сколько пи-связей образуется при sp2-гибридизации в этилене C2H4?
Когда в этилене происходит sp2-гибридизация, между двумя атомами углерода образуется пи-связь. Гибридные sp2-орбитали участвуют в образовании сигма-связей между атомами углерода и атомами водорода, а p-орбитали каждого атома углерода перекрываются, образуя пи-связь. Этилен классифицируется как ненасыщенный углеводород, поскольку он имеет двойную связь между двумя атомами углерода. Эта двойная связь состоит из одной сигма-связи и одной пи-связи, что означает, что этилен имеет меньше атомов водорода, чем сопоставимый насыщенный углеводород с таким же количеством атомов углерода.
