Этан — углеводород с химической формулой C2H6. Он широко используется в качестве топлива и является компонентом природного газа. Этан имеет два атома углерода и шесть атомов водорода.
| Название ИЮПАК | Этан |
| Молекулярная формула | C2H6 |
| Количество CAS | 74-84-0 |
| Синонимы | Диэтил, диметил, этилгидрид, метилметан |
| ИнЧИ | ИнЧИ=1S/C2H6/c1-2/h1-2H3 |
Свойства этана
Формула этана
Химическая формула этана — C2H6. Это указывает на то, что каждая молекула этана состоит из двух атомов углерода и шести атомов водорода. Формула помогает нам понять состав этана и его структурное устройство.
этан Молярная масса
Молярную массу этилгидрида рассчитывают путем сложения атомных масс составляющих его элементов. Атомная масса углерода составляет 12,01 г/моль, а атомная масса водорода — 1,008 г/моль. Умножение атомных масс на их соответствующие количества и их сложение дает молярную массу этилгидрида, которая составляет примерно 30,07 г/моль.
Температура кипения этана
Этилгидрид имеет температуру кипения -88,6 градусов Цельсия. Это означает, что при стандартном атмосферном давлении этилгидрид переходит из жидкости в газ при нагревании до этой температуры. Температура кипения является важным свойством, поскольку она определяет условия, при которых этилгидрид может испаряться.
Температура плавления этана
Температура плавления этилгидрида составляет -182,8 градуса Цельсия. При температурах ниже этой точки этилгидрид существует в твердой форме. При нагревании до этой температуры или выше этилгидрид претерпевает фазовый переход из твердого состояния в жидкое. Температура плавления имеет решающее значение для понимания физического поведения этилгидрида во время процессов охлаждения или нагревания.
Плотность этана г/мл
Плотность этилгидрида составляет примерно 0,55 г/мл при стандартных температуре и давлении. Плотность является мерой количества массы, присутствующей в данном объеме. В случае этилгидрида он говорит нам, насколько плотно упакованы его молекулы, и дает представление о его физических свойствах.
Этан Молекулярный вес
Молекулярная масса этилгидрида составляет 30,07 г/моль. Это сумма атомных масс всех атомов в одной молекуле этилгидрида. Молекулярный вес помогает нам определить, сколько этилгидрида присутствует в данной массе или объеме.
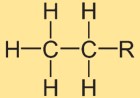
Структура этана
Структура этилгидрида состоит из двух атомов углерода, связанных между собой одинарной ковалентной связью. Каждый атом углерода окружен тремя атомами водорода. Структурное расположение линейное, атомы водорода расположены симметрично вокруг связи углерод-углерод.
Растворимость этана
Этилгидрид плохо растворяется в воде. Это неполярная молекула, а вода является полярным растворителем. Неполярные молекулы, такие как этилгидрид, обладают слабыми межмолекулярными силами и плохо растворяются в полярных растворителях. Однако этилгидрид может растворяться в других неполярных растворителях, таких как гексан или бензол.
| Появление | Бесцветный газ |
| Удельный вес | 1,038 г/л |
| Цвет | Н/Д |
| Запах | Без запаха |
| Молярная масса | 30,07 г/моль |
| Плотность | 0,55 г/мл |
| Точка плавления | -182,8°С |
| Точка кипения | -88,6°С |
| Мигающая точка | -135°С |
| Растворимость в воде | нерастворимый |
| Растворимость | Растворим в неполярных растворителях. |
| Давление газа | 46,9 фунтов на квадратный дюйм (при 21°C) |
| Плотность пара | 1,52 (воздух = 1) |
| пКа | ~50 |
| рН | Н/Д |
Этан Безопасность и опасности
Этилгидрид представляет собой несколько соображений безопасности и опасностей. Он легко воспламеняется и может образовывать взрывоопасные смеси с воздухом. При воздействии пламени или источника тепла этилгидрид может воспламениться, что приведет к пожару или взрыву. Важно обращаться и хранить этилгидрид в хорошо проветриваемых помещениях, вдали от источников возгорания. Этилгидрид также представляет опасность удушья, поскольку он вытесняет кислород в закрытых помещениях. Вдыхание высоких концентраций этилгидрида может вызвать головокружение, тошноту и даже потерю сознания. Чтобы снизить эти риски, важно использовать соответствующие средства индивидуальной защиты и соблюдать протоколы безопасности при работе с этилгидридом или рядом с ним.
| Символы опасности | Горючий газ |
| Описание безопасности | Беречь от источников тепла, искр и открытого огня. Используйте в хорошо вентилируемых помещениях. Обращайтесь с соответствующими мерами предосторожности во избежание риска возгорания или взрыва. |
| Идентификационные номера ООН | ООН1035 |
| код ТН ВЭД | 29011000 |
| Класс опасности | 2.1 (Горючий газ) |
| Группа упаковки | Непригодный |
| Токсичность | Этан не считается высокотоксичным. Однако вдыхание высоких концентраций может вызвать удушье. Используйте при достаточной вентиляции и избегайте длительного воздействия. |
Методы синтеза этана
Этилгидрид синтезируют различными методами.
Распространенным методом является процесс парового крекинга, при котором при высоких температурах (около 750–900 °C) углеводороды, обычно этилгидрид или более тяжелые углеводороды, нагреваются в присутствии пара. Этот процесс запускает реакции, включая термическое разложение и перегруппировку, с образованием этилгидрида, этилена и пропилена.
Другой метод включает каталитическое гидрирование ацетилена , при котором газообразный ацетилен реагирует с водородом на подходящих катализаторах, таких как палладий или никель, с образованием этилгидрида. Этот метод избирательно преобразует высокореактивный и потенциально опасный ацетилен в более стабильный и менее реакционноспособный этилгидрид.
Этан также можно получить из природного газа методом криогенной экстракции. Природный газ, в первую очередь метилгидрид, подвергается воздействию низких температур и высокого давления для отделения и извлечения этилгидрида. Заводы по переработке природного газа обычно используют этот процесс для извлечения ценного этилгидрида для различных промышленных применений.
Кроме того, при переработке нефти и некоторых нефтехимических процессах в качестве побочного продукта образуется этилгидрид. Такие методы, как перегонка или абсорбция, отделяют этилгидрид от других потоков углеводородов.
В целом, эти методы синтеза позволяют производить этилгидрид, важнейшее сырье для производства широкого спектра химикатов, пластмасс и топлива, что способствует развитию многих отраслей промышленности по всему миру.
Использование этана
Этилгидрид находит применение в различных отраслях промышленности благодаря своим универсальным свойствам. Вот некоторые ключевые области применения этилгидрида:
- Нефтехимическая промышленность: Этилгидрид является важным сырьем для производства этилена, который служит основой для пластмасс, смол и синтетических волокон. Это ключевой элемент в производстве полиэтилена, одного из наиболее используемых пластиков в мире.
- Топливо и энергетика: Этилгидрид играет роль в заправке и обеспечении энергией конкретных промышленных процессов и является составной частью природного газа. Промышленность сжигает этилгидрид для производства тепла или электроэнергии, служащего источником энергии для жилых, коммерческих и промышленных предприятий.
- Охлаждение. В некоторых применениях, например, в низкотемпературных системах, этилгидрид служит хладагентом, обеспечивая эффективное охлаждение. Он предлагает эффективные возможности охлаждения и является альтернативой другим хладагентам с более высоким воздействием на окружающую среду.
- Растворитель: Этилгидрид служит неполярным растворителем, особенно в лаборатории. Этилгидрид облегчает такие процессы, как экстракция, очистка и анализ.
- Калибровочный газ: Этилгидрид служит компонентом при калибровке газовых смесей для детекторов и анализаторов газа, обеспечивая возможность калибровки и проверки оборудования для обнаружения газа.
- Аэрозольный пропеллент: Этилгидрид действует как аэрозольный пропеллент в различных продуктах, вытесняя их содержимое из контейнера при сбросе давления. Он придает силу, необходимую для распыления таких веществ, как косметика, краски и товары для дома.
- Химический синтез: Этилгидрид служит сырьем для синтеза различных органических химикатов, включая этанол, оксид этилена и винилхлорид. Эти химикаты находят применение, среди прочего, в производстве растворителей, пластмасс, моющих средств и труб из ПВХ.
Эти разнообразные применения подчеркивают важность этилгидрида во многих отраслях промышленности, что делает его важнейшим элементом в современном производстве и повседневной жизни.
Вопросы:
Вопрос: C2H6 полярный или неполярный?
Ответ: C2H6 (этилгидрид) является неполярной молекулой, поскольку разница в электроотрицательности между углеродом и водородом невелика, что приводит к равномерному распределению электронной плотности.
Вопрос: Сколько молей атомов углерода содержится в 0,500 молях C2H6?
Ответ: В 0,500 молях C2H6 содержится 1,00 молей атомов углерода, поскольку каждая молекула C2H6 содержит 2 атома углерода.
Вопрос: Какова эмпирическая формула C2H6?
Ответ: Эмпирическая формула C2H6 — CH3, что представляет собой простейшее соотношение атомов, присутствующих в молекуле.
Вопрос: Что такое C2H6?
Ответ: C2H6 — это химическая формула этилгидрида, газообразного углеводорода, обычно используемого в качестве топлива и компонента природного газа.
Вопрос: Почему этан (C2H6) не имеет структурных изомеров?
Ответ: Этилгидрид (C2H6) не имеет структурных изомеров, поскольку его атомы углерода соединены одинарной связью, что приводит к линейной структуре без другого возможного расположения.
Вопрос: Есть ли у C2H6 водородная связь?
Ответ: C2H6 (этилгидрид) не имеет водородной связи, поскольку в нем отсутствуют атомы водорода, связанные с сильно электроотрицательными элементами, такими как азот, кислород или фтор.
Вопрос: Является ли C2H6 ионным или ковалентным?
Ответ: C2H6 является ковалентным соединением, поскольку оно образуется в результате совместного использования электронов между атомами углерода и водорода.
Вопрос: Растворим ли C2H6 в воде?
Ответ: C2H6 нерастворим в воде, поскольку является неполярной молекулой и плохо растворяется в полярном растворителе.
Вопрос: Содержит ли газовая смесь CH4 и C2H6 в эквимолярной пропорции?
Ответ: Да, если газовая смесь содержит CH4 и C2H6 в эквимолярной пропорции, это означает, что количество молей CH4 равно количеству молей C2H6 в смеси.
