Хромовая кислота — сильный коррозионный окислитель, используемый в различных целях, таких как очистка металлов, гравировка и в некоторых лабораторных экспериментах. Он красного цвета.
| Название ИЮПАК | Хромовая кислота |
| Молекулярная формула | H2CrO4 |
| Количество CAS | 7738-94-5 |
| Синонимы | Хромовая (VI) кислота, хромовая кислота, дигидроксидиоксидохром, диводород (тетраоксидохромат) |
| ИнЧИ | InChI=1S/Cr.H2O4/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 |
Свойства хромовой кислоты
Формула хромовой кислоты
Химическая формула хромовой кислоты: H2CrO4. Он состоит из двух атомов водорода, одного атома хрома и четырех атомов кислорода. Формула представляет состав хромовой кислоты на молекулярном уровне.
хромовая кислота Молярная масса
Молярную массу хромовой кислоты можно рассчитать путем сложения атомных масс составляющих ее элементов. Атомная масса хрома составляет 51,996 грамма на моль, молярная масса водорода составляет 1,008 грамма на моль, а молярная масса кислорода составляет 16,00 грамма на моль. Следовательно, молярная масса хромовой кислоты составляет примерно 118,00 грамм на моль.
Температура кипения хромовой кислоты
Хромовая кислота не имеет четкой точки кипения, поскольку при нагревании она разлагается с выделением газообразного кислорода. Однако температура его разложения составляет около 190°C (374°F). При нагревании хромовая кислота вступает в химическую реакцию, в результате которой образуются триоксид хрома и вода.
Температура плавления хромовой кислоты
Температура плавления хромовой кислоты точно не определена из-за ее склонности к разложению перед плавлением. Однако известно, что хромовая кислота может разлагаться при температуре около 250°C (482°F) или даже ниже, в зависимости от условий.
Плотность хромовой кислоты г/мл
Хромовая кислота имеет плотность примерно 1,2 грамма на миллилитр (г/мл) при комнатной температуре. Это значение плотности указывает на то, что хромовая кислота относительно плотна по сравнению с водой.
Хромовая кислота Молекулярный вес
Молекулярную массу хромовой кислоты рассчитывают путем сложения атомных масс составляющих ее элементов. В этом случае молекулярная масса составляет примерно 118,00 грамм на моль.
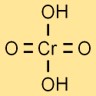
Структура хромовой кислоты
Структура хромовой кислоты представлена центральным атомом хрома, связанным с четырьмя атомами кислорода и двумя атомами водорода. Атомы кислорода расположены вокруг атома хрома в тетраэдрической форме.
Растворимость хромовой кислоты
Хромовая кислота умеренно растворима в воде, а значит, может растворяться в некоторой степени. Растворимость увеличивается с повышением температуры. Однако с ним следует обращаться осторожно, поскольку он является коррозийным веществом.
| Появление | Темно-красные кристаллы |
| Удельный вес | 2,70 |
| Цвет | Красный |
| Запах | Без запаха |
| Молярная масса | 118,01 г/моль |
| Плотность | 1201 г/мл |
| Точка плавления | Разлагается при ~190°C |
| Точка кипения | Разлагается при ~250°C |
| Мигающая точка | Непригодный |
| Растворимость в воде | Растворимый |
| Растворимость | Растворим в воде и органических растворителях, таких как этанол, эфир. |
| Давление газа | Непригодный |
| Плотность пара | Непригодный |
| пКа | -0,64 |
| рН | Очень кислый (pH < 1) |
Безопасность и вред хромовой кислоты
Хромовая кислота представляет собой ряд рисков для безопасности, и с ней следует обращаться с осторожностью. Это едкое вещество, которое при контакте может вызвать серьезные ожоги кожи, глаз и дыхательной системы. Вдыхание паров или тумана хромовой кислоты может вызвать раздражение дыхательных путей и вызвать кашель, одышку и повреждение легких. Он также очень токсичен при проглатывании, вызывая боли в животе, рвоту и потенциальное повреждение органов. Кроме того, хромовая кислота является сильным окислителем и может бурно реагировать или воспламенять легковоспламеняющиеся вещества. При работе с хромовой кислотой следует надевать соответствующие защитные средства, такие как перчатки, очки и лабораторный халат, а хранить и утилизировать их следует в соответствии с правилами техники безопасности.
| Символы опасности | Коррозионное, Окисляющее |
| Описание безопасности | – Вызывает сильные ожоги – Может возникнуть интенсивный пожар; окислитель – Вреден при проглатывании – Вызывает раздражение дыхательных путей – Вызывает повреждение глаз – Может вызывать генетические дефекты – Может вызывать рак – Может нанести ущерб фертильности или будущему ребенку – Очень токсичен для водных организмов – Обращайтесь и утилизируйте правильно |
| Идентификационные номера ООН | ООН1755, ООН1463 |
| код ТН ВЭД | 28191000 |
| Класс опасности | 8 (Коррозионный) |
| Группа упаковки | II (средний уровень) |
| Токсичность | Очень токсичен и вреден |
Методы синтеза хромовой кислоты
Существует несколько методов синтеза хромовой кислоты.
Распространенный метод включает реакцию дихромата натрия (Na2Cr2O7) и серной кислоты (H2SO4) . В этом процессе вы медленно добавляете дихромат натрия к серной кислоте при перемешивании. Реакция протекает с образованием хромовой кислоты (H2CrO4) и сульфата натрия (Na2SO4) в качестве побочного продукта. Полученный раствор хромовой кислоты можно очистить и сконцентрировать, удалив избыток воды.
Как и в предыдущем методе, мы можем добавить хромат калия к серной кислоте , в результате чего в качестве побочного продукта образуется хромовая кислота и сульфат калия (K2SO4) .
Альтернативно вы можете получить хромовую кислоту путем взаимодействия триоксида хрома (CrO3) с водой. Вы растворяете триоксид хрома в воде, в результате чего образуется раствор хромовой кислоты.
Помните, что хромовая кислота – очень агрессивное и опасное вещество. Поэтому его синтез следует проводить с соблюдением соответствующих мер безопасности и в хорошо проветриваемом помещении. Во время процесса синтеза надевайте защитное оборудование, такое как перчатки, очки и лабораторный халат. Также следуйте надлежащим методам утилизации, чтобы обеспечить безопасное обращение и утилизацию любых отходов, образующихся во время синтеза.
Использование хромовой кислоты
Хромовая кислота находит разнообразное применение благодаря своим свойствам мощного окислителя. Вот некоторые распространенные варианты использования:
- Очистка металла: Хромовая кислота эффективно удаляет ржавчину, окалину и органические отложения с металлических поверхностей, очищая и удаляя поверхностные загрязнения.
- Травление: Хромовая кислота создает тонкие узоры и узоры на поверхностях, таких как стекло, керамика и металлы, травит их и делает ее полезной при производстве декоративной стеклянной посуды и электронных схем.
- Подготовка поверхности: в промышленных процессах хромовая кислота используется для подготовки поверхностей к покраске, нанесению покрытия или склеиванию, обеспечивая хорошую адгезию за счет удаления загрязнений и создания чистой поверхности.
- Аналитическая химия. Химики и лаборатории используют хромовую кислоту в качестве окислителя в химических анализах и лабораторных экспериментах, определяя концентрации определенных органических соединений.
- Консервация древесины: Хромовая кислота действует как консервант древесины, проникая глубоко в волокна древесины и защищая ее от гниения, заражения насекомыми и атмосферных воздействий.
- Текстильная промышленность: В текстильной промышленности хромовая кислота используется в процессах крашения и печати, фиксации красителей в тканях и улучшения стойкости цвета.
- Фотография: Хромовая кислота играет роль в некоторых фотографических процессах, включая производство цветных отпечатков и цветной обратимой пленки.
- Гальваника: В процессах гальваники, особенно при хромировании, хромовая кислота служит источником ионов хрома, которые осаждаются на металлических поверхностях, образуя защитное и декоративное покрытие.
Важно отметить, что хромовая кислота является опасным веществом, и при обращении с ней, ее хранении и утилизации следует принимать соответствующие меры предосторожности.
Вопросы:
Вопрос: Что происходит, когда фенол окисляется хромовой кислотой?
Ответ: Фенол подвергается окислению хромовой кислотой, в результате чего образуются хиноны и вода.
Вопрос: Как приготовить хромовую кислоту?
Ответ: Хромовую кислоту можно получить путем взаимодействия дихромата натрия или хромата калия с серной кислотой.
Вопрос: Как сделать хромовую кислоту?
Ответ: Хромовую кислоту можно получить путем смешивания соединения хрома (например, триоксида хрома) с водой.
Вопрос: Что такое хромовая кислота?
Ответ: Хромовая кислота является сильным и агрессивным окислителем, состоящим из хрома, водорода и кислорода.
Вопрос: Восстанавливает ли хромовая кислота алкены?
О: Нет, хромовая кислота является окислителем и не обладает восстановительными свойствами.
Вопрос: Как приготовить хромовую кислоту для очистки лабораторной посуды?
Ответ: Чистящий раствор хромовой кислоты можно приготовить путем растворения триоксида хрома в воде и добавления серной кислоты.
Вопрос: Является ли хромовая кислота сильной кислотой?
Ответ: Да, хромовая кислота считается сильной кислотой из-за ее способности отдавать протоны.
Вопрос: Как приготовить чистящий раствор хромовой кислоты?
Ответ: Чтобы приготовить чистящий раствор хромовой кислоты, растворите триоксид хрома в воде и добавьте небольшое количество серной кислоты.
Вопрос: Какой из следующих спиртов даст положительный результат теста на хромовую кислоту?
Ответ: Первичные спирты могут дать положительный результат теста на хромовую кислоту, вызывая изменение цвета с оранжевого на зеленый или синий.
