Хлорная кислота (HClO3) — сильная нестабильная кислота, которую можно получить путем смешивания диоксида хлора с водой. Его используют в отбеливающих и дезинфицирующих средствах, а также в производстве взрывчатых веществ.
| Название ИЮПАК | Хлорная кислота |
| Молекулярная формула | HClO3 |
| Количество CAS | 7790-93-4 |
| Синонимы | Хлорная кислота, хлорат; Раствор хлорной кислоты; Хлорная кислота (V); хлорат водорода; Трихлорат водорода |
| ИнЧИ | InChI=1S/ClHO3/c2-1(3)4/h(H,2,3,4) |
Свойства хлорной кислоты (HClO3) представляют особый интерес для химиков и инженеров из-за ее широкого промышленного применения.
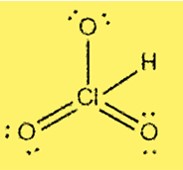
Структура Льюиса HClO3
Структура Льюиса HClO3 показывает, что хлор является центральным атомом, связанным с тремя атомами кислорода и одним атомом водорода. Хлор имеет 7 валентных электронов, а каждый кислород имеет 6 валентных электронов. В структуре присутствуют три одинарные связи и одна двойная связь между атомами хлора и кислорода.
Формула хлорной кислоты (HClO3)
Химическая формула хлорной кислоты (HClO3) – HClO3. Это неорганическая кислота, содержащая один атом хлора, один атом водорода и три атома кислорода. Формула хлорной кислоты (HClO3) используется для расчета стехиометрии и концентрации растворов, содержащих кислоту.
Молярная масса хлорной кислоты (HClO3)
Молярная масса хлорной кислоты (HClO3) составляет 84,46 г/моль. Это относительно легкая кислота по сравнению с другими неорганическими кислотами, такими как серная кислота, молярная масса которой составляет 98,08 г/моль. Молярная масса хлорной кислоты (HClO3) является важным параметром при расчете концентрации и стехиометрии растворов, содержащих кислоту.
Температура кипения хлорной кислоты (HClO3)
Хлорная кислота (HClO3) имеет температуру кипения 40,5°С. Это очень летучая кислота, которая может разлагаться при высоких температурах, что затрудняет обращение и хранение. Низкая температура кипения хлорной кислоты (HClO3) является важным фактором при проектировании оборудования и процессов, связанных с использованием кислоты.
Температура плавления хлорной кислоты (HClO3)
Хлорная кислота (HClO3) не имеет четко определенной температуры плавления. Он может разлагаться, не достигнув точки плавления, выделяя газообразный кислород и оставляя после себя остаток хлоратов. Отсутствие четкой температуры плавления связано с нестабильностью хлорной кислоты (HClO3).
Плотность хлорной кислоты (HClO3), г/мл
Плотность хлорной кислоты (HClO3) составляет 1,97 г/см³. Это относительно плотная кислота по сравнению с другими неорганическими кислотами, такими как соляная кислота, плотность которой составляет 1,18 г/см³. Высокая плотность хлорной кислоты (HClO3) является важным фактором при разработке процессов, связанных с обработкой и транспортировкой кислоты.
Молекулярный вес хлорной кислоты (HClO3)
Молекулярная масса хлорной кислоты (HClO3) составляет 84,46 г/моль. Это сумма атомных весов составляющих его элементов: одного атома хлора, одного атома водорода и трех атомов кислорода. Молекулярная масса хлорной кислоты (HClO3) является важным параметром при расчете концентрации и стехиометрии растворов, содержащих кислоту.
Структура хлорной кислоты (HClO3)
Структура хлорной кислоты состоит из центрального атома хлора, связанного с тремя атомами кислорода и одним атомом водорода. Молекула имеет тетраэдрическую геометрию с атомом хлора в центре тетраэдра. Три атома кислорода расположены вокруг атома хлора в тригональном плоском расположении, а атом водорода связан с одним из атомов кислорода. Структура хлорной кислоты (HClO3) важна для понимания ее химических свойств и реакционной способности.
| Появление | Прозрачная или желтоватая жидкость |
| Удельный вес | 1,97 |
| Цвет | От бесцветного до желтого |
| Запах | Без запаха |
| Молярная масса | 84,46 г/моль |
| Плотность | 1,68 г/см³ |
| Точка плавления | Разлагается перед плавлением |
| Точка кипения | 40,5°С |
| Мигающая точка | Непригодный |
| Растворимость в воде | смешивается |
| Растворимость | Растворим в большинстве органических растворителей. |
| Давление газа | Непригодный |
| Плотность пара | Непригодный |
| ПКа | -0,6 |
| PH | <1 |
Хлорная кислота (HClO3) Безопасность и опасности
Хлорная кислота (HClO3) представляет несколько рисков для безопасности, и с ней следует обращаться осторожно. Это сильный окислитель, который может бурно реагировать со многими органическими материалами, включая топливо, восстановители и легковоспламеняющиеся жидкости. При попадании он может вызвать серьезные ожоги кожи и глаз, а также вызвать коррозию металлических поверхностей. Вдыхание его паров может вызвать раздражение дыхательных путей и кашель. Из-за своей реактивной природы его следует хранить и обращаться с ним в хорошо проветриваемом помещении, вдали от других химикатов. При работе с хлорной кислотой следует надевать защитное оборудование, такое как перчатки, очки и респиратор, чтобы избежать воздействия. При попадании на кожу или в глаза следует немедленно обратиться за медицинской помощью.
| Символы опасности | Окислитель |
| Описание безопасности | Избегайте контакта с кожей и глазами; носить защитное снаряжение |
| Идентификаторы сети | ООН 3084 |
| код ТН ВЭД | 2811,19 |
| Класс опасности | 5.1 |
| Группа упаковки | II |
| Токсичность | Коррозионный; может вызвать серьезные ожоги кожи и глаз |
Методы синтеза хлорной кислоты (HClO3)
Хлорную кислоту можно синтезировать несколькими методами, включая реакцию газообразного хлора с гидроксидом натрия или хлоратом натрия. Распространенным методом является реакция хлората натрия с соляной кислотой.
Реакция синтеза хлорной кислоты включает реакцию хлората натрия (NaClO3) с соляной кислотой (HCl) в двухстадийном процессе. Первый этап включает преобразование хлората натрия в хлорит натрия (NaClO2) и газообразный диоксид хлора (ClO2) в присутствии кислотного катализатора. На втором этапе газообразный диоксид хлора реагирует с избытком соляной кислоты с образованием хлорной кислоты и газообразного хлора.
Другой метод синтеза хлорной кислоты включает электролиз раствора, содержащего хлорид натрия, азотную и серную кислоты. В результате этого процесса образуется газообразный хлор, который вступает в реакцию с водой с образованием хлорной кислоты.
Для получения хлорной кислоты хлорат калия можно ввести в реакцию с серной кислотой, а затем полученную смесь перегнать.
Синтез хлорной кислоты требует осторожного обращения с реагентами из-за риска бурных реакций и коррозионной природы участвующих кислот. Важно соблюдать надлежащие протоколы безопасности и обращаться с материалами в хорошо проветриваемом помещении, используя соответствующее защитное оборудование.
Использование хлорной кислоты (HClO3)
Хлорная кислота (HClO3) находит применение в различных отраслях промышленности благодаря своим сильным окислительным свойствам. Некоторые из его применений:
- Производство других химикатов: Хлорная кислота служит промежуточным продуктом в производстве других химикатов, включая хлорную кислоту, хлораты и перхлораты.
- Отбеливатель: В целлюлозно-бумажной промышленности в качестве отбеливателя используется хлорная кислота.
- Дезинфицирующее средство: Хлорная кислота действует как дезинфицирующее средство в пищевой промышленности и производстве напитков для дезинфекции оборудования и поверхностей.
- Травление. В полупроводниковой промышленности в качестве травителя для удаления нежелательных слоев материала с полупроводниковых пластин используется хлорная кислота.
- Лабораторный реагент: Хлорная кислота используется в качестве лабораторного реагента в аналитической химии и органическом синтезе.
- Окислитель: Хлорная кислота используется в качестве окислителя в реакциях органической химии.
- Ракетное топливо: Хлорная кислота служит окислителем в ракетном топливе.
- Очистка воды: Хлорная кислота используется при очистке воды для контроля роста водорослей и бактерий.
Вопросы:
Вопрос: Является ли хлорная кислота сильной кислотой?
Ответ: Да, хлорная кислота (HClO3) является сильной кислотой.
Вопрос: Какая формула обозначает хлорную кислоту?
Ответ: Формула хлорной кислоты: HClO3.
Вопрос: Объясните, почему HCl — это соляная кислота, а HClO3 — хлорная кислота?
Ответ: Названия бинарных кислот (соединений, содержащих только два элемента) обычно происходят от названия аниона с суффиксом -ic для наиболее распространенного аниона и -ous для наименее распространенного. В случае HCl анионом является хлорид (Cl-), поэтому кислота называется соляной. В случае HClO3 анионом является хлорат (ClO3-), поэтому кислота называется хлорной.
Вопрос: Какова формула хлорной кислоты?
Ответ: Формула хлорной кислоты: HClO3.
Вопрос: Хлорная кислота ионная или молекулярная?
Ответ: Хлорная кислота является молекулярной, поскольку состоит из ковалентно связанных атомов водорода, хлора и кислорода.
