Хлорид магния (MgCl2) представляет собой соединение, состоящее из ионов магния и хлорида. Его обычно используют в качестве добавки для лечения дефицита магния, а также в качестве антиобледенителя для дорог и тротуаров.
| Название ИЮПАК | Хлорид магния |
| Молекулярная формула | MgCl2 |
| Количество CAS | 7786-30-3 |
| Синонимы | Дихлорид магния, хлормагнезит, бихлормагний, хлорид магния (II), Е511, Нигари |
| ИнЧИ | InChI=1S/2ClH.Mg/h2*1H;/q;;+2/p-2 |
Формула хлорида магния
Химическая формула хлорида магния – MgCl2. Эта формула указывает на то, что хлорид магния состоит из одного иона Mg+2 и двух ионов Cl-. Формула важна при определении количества хлорида магния, необходимого для химических реакций. Хлорид магния обычно используется в качестве добавки для лечения дефицита магния и в качестве антиобледенителя для дорог и тротуаров.
Молярная масса of хлорид магния
Молярная масса хлорида магния составляет 95,21 г/моль. Это кристаллическое соединение, состоящее из одного иона Mg+2 и двух ионов Cl-. Молярная масса — важное свойство хлорида магния, поскольку она используется для расчета количества вещества в химических реакциях. Хлорид магния обычно используется в качестве добавки для лечения дефицита магния и в качестве антиобледенителя для дорог и тротуаров.
Температура кипения MgCl2
MgCl2 имеет высокую температуру кипения — 1412°C, а это значит, что для разрыва связей между его атомами и молекулами требуется много энергии. Это свойство делает его полезным при высоких температурах, например, при производстве металлов и сплавов. MgCl2 также используется в качестве осушителя для поглощения влаги из воздуха и в качестве катализатора в химических реакциях.
Температура плавления MgCl2
Температура плавления MgCl2 составляет 714°C, что означает, что при комнатной температуре он является твердым. Это свойство делает его полезным в различных областях применения, например, при производстве металлического магния и в качестве флюса при сварке алюминия. MgCl2 также используется в качестве коагулянта при производстве тофу и других соевых продуктов.
Плотность MgCl2 г/мл
Плотность MgCl2 составляет 2,32 г/мл. Это свойство делает его полезным в различных областях применения, таких как производство огнезащитных материалов и очистка сточных вод. MgCl2 также используется в качестве средства подавления пыли на дорогах и при строительстве шоссе.
Молекулярный вес MgCl2
Молекулярная масса MgCl2 составляет 95,21 г/моль. Это свойство важно для определения количества MgCl2, необходимого для химических реакций. MgCl2 обычно используется в качестве добавки для лечения дефицита магния и в качестве антиобледенителя дорог и тротуаров.
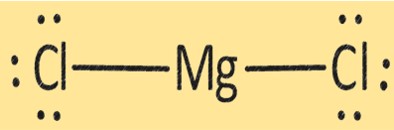
Структура MgCl2
MgCl2 имеет кристаллическую структуру, состоящую из одного иона Mg+2 и двух ионов Cl-. Структура MgCl2 важна для определения его физических и химических свойств. MgCl2 используется в различных областях, например, при производстве металлического магния, в качестве осушителя и коагулянта при производстве тофу и других соевых продуктов.
| Появление | Белое кристаллическое твердое вещество |
| Удельный вес | 2,32 г/мл |
| Цвет | Белый |
| Запах | Без запаха |
| Молярная масса | 95,21 г/моль |
| Плотность | 2,32 г/мл |
| Точка плавления | 714°С |
| Точка кипения | 1412°С |
| Мигающая точка | Непригодный |
| Растворимость в воде | Очень растворим |
| Растворимость | Растворим в воде, этаноле, метаноле. |
| Давление газа | Непригодный |
| Плотность пара | Непригодный |
| пКа | 7,6 (для ионов Mg(H2O)6^2+) |
| рН | 6,0 – 8,0 |
Безопасность и опасность хлорида магния
Хлорид магния (MgCl2) обычно считается безопасным при использовании по назначению. Однако при неправильном обращении он может представлять некоторую опасность. Это может вызвать раздражение кожи и глаз, а вдыхание пыли может вызвать проблемы с дыханием. Проглатывание большого количества MgCl2 может вызвать тошноту, рвоту и диарею. Он также может быть вредным для водной флоры и фауны, если попадет в водные пути. При работе с MgCl2 следует надевать соответствующее защитное оборудование, такое как перчатки и очки. Любые разливы или выбросы необходимо немедленно локализовать и убирать, чтобы избежать ущерба окружающей среде.
| Символы опасности | Ничего не назначено |
| Описание безопасности | Избегайте контакта с кожей и глазами. В случае попадания промыть водой. При работе надевайте перчатки и очки. |
| Идентификационные номера ООН | ОДИН 2019 |
| код ТН ВЭД | 28273100 |
| Класс опасности | 8 |
| Группа упаковки | III |
| Токсичность | ЛД50 (перорально, крыса) – 4640 мг/кг; LC50 (ингаляционно, крыса) – >4,4 мг/л в течение 4 часов |
Методы синтеза хлорида магния
MgCl2 можно синтезировать различными методами, включая прямой синтез, реакцию с соляной кислотой и реакцию с MgO.
Чтобы получить MgCl2 путем прямого синтеза, сожгите металлический магний на воздухе или в газообразном хлоре, чтобы получить MgO. Затем проведите реакцию MgO с соляной кислотой с образованием MgCl2:
Mg + O2 → MgO
MgO + 2HCl → MgCl2 + H2O
Другой метод включает реакцию металлического Mg с соляной кислотой с образованием MgCl2 и газообразного водорода:
Mg + 2HCl → MgCl2 + H2
Для реакции с MgO смешиваем MgO с соляной кислотой , чтобы получить MgCl2 и воду:
MgO + 2HCl → MgCl2 + H2O
При смешивании MgO с соляной кислотой при реакции с MgO образуется хлорид магния и вода:
Mg(OH)2 + 2HCl → MgCl2 + 2H2O
Кроме того, мы можем получить MgCl2 как побочный продукт процесса Сольве, в результате которого образуется карбонат натрия . В результате процесса в качестве побочных продуктов образуются хлорид кальция и MgCl2, которые можно отделить от раствора карбоната натрия.
Использование хлорида магния
Хлорид магния имеет широкий спектр применения в различных отраслях промышленности, в том числе:
- Противообледенительный агент: используется в качестве противообледенительного средства на дорогах и тротуарах в зимние месяцы из-за его способности снижать температуру замерзания воды.
- Dust Control: используется в качестве средства для борьбы с пылью на грунтовых дорогах и строительных площадках.
- Пищевая промышленность: используется в качестве коагулянта при производстве тофу и как источник магния в некоторых пищевых продуктах.
- Лекарство: используется в медицинских целях в качестве добавки при дефиците магния и для лечения определенных состояний, таких как запор и изжога.
- Сельское хозяйство: используется в качестве удобрения и кондиционера почвы для улучшения содержания магния в почве и роста растений.
- Водоочистка: используется в процессах очистки воды для удаления примесей и смягчения жесткой воды.
- Промышленное применение: Используется в производстве текстиля, бумаги и цемента, а также в различных промышленных процессах.
- Здоровье и хорошее самочувствие: используется в различных оздоровительных практиках, таких как купание, для расслабления и улучшения здоровья кожи.
Вопросы:
Вопрос: Какова формула хлорида магния?
Ответ: Формула хлорида магния: MgCl2.
Вопрос: Что такое хлорид магния?
Ответ: MgCl2 — это неорганическое соединение, обычно используемое в различных отраслях промышленности и применениях, в том числе в качестве противообледенительного средства, средства для борьбы с пылью и пищевой добавки.
Вопрос: Растворим ли хлорид магния?
О: Да, MgCl2 растворим в воде и других полярных растворителях.
Вопрос: Является ли хлорид магния ионным или ковалентным?
Ответ: MgCl2 — ионное соединение, состоящее из катиона (Mg2+) и аниона (Cl-).
Вопрос: Что такое MgCl2?
Ответ: MgCl2 — это химическая формула хлорида магния, неорганического соединения, используемого в различных промышленных и потребительских целях.
Вопрос: Каково чистое ионное уравнение реакции MgCl2 с NaOH?
A: Итоговое ионное уравнение реакции MgCl2 с NaOH: Mg2+ (водный раствор) + 2OH- (водный раствор) → Mg(OH)2 (тв).
