Хлорид калия (KCl) представляет собой соединение, содержащее калий и хлор. Его используют в качестве удобрения, пищевой добавки и для лечения низкого уровня калия. Его также можно использовать в смертельных инъекциях.
| Название ИЮПАК | Хлорид калия |
| Молекулярная формула | КСl |
| Количество CAS | 7447-40-7 |
| Синонимы | KCl, хлорат калия, хлористый калий, сильвит, хлоропотассурил, калитабс, клотрикс, хлор-кон, к-дур. |
| ИнЧИ | InChI=1S/ClH.K/h1H;/q;+1/p-1 |
Формула хлорида калия
Химическая формула хлорида калия – KCl. Это бинарное соединение, состоящее из одного атома калия и одного атома хлора. Формула хлорида калия важна для понимания его химических свойств и проведения расчетов, связанных с его использованием в различных приложениях.
Молярная масса of хлорид калия
Молярная масса KCl составляет 74,55 г/моль. Это белое кристаллическое вещество с соленым вкусом, хорошо растворимое в воде. KCl – это соединение, состоящее из одного атома калия и одного атома хлора.
Температура кипения хлорида калия
Температура кипения KCl составляет 1420 ° C (2588 ° F). Это соединение с высокой температурой плавления, для достижения точки кипения которого требуется значительная энергия. Высокая температура кипения KCl делает его полезным в высокотемпературных применениях, например, в производстве керамики и стекла.
Температура плавления KCl
Температура плавления KCl составляет 770°C (1418°F). Это соединение с относительно высокой температурой плавления, для плавления которого требуется значительное количество тепла. KCl используется в производстве удобрений, а его высокая температура плавления помогает обеспечить его стабильность при высоких температурах.
Плотность KCl г/мл
Плотность KCl составляет 1,98 г/см³. Это относительно плотное соединение, а это означает, что небольшое количество содержит большое количество частиц. Высокая плотность KCl делает его полезным в некоторых отраслях промышленности, например, при производстве буровых растворов.
Молекулярный вес KCl
Молекулярная масса KCl составляет 74,55 г/моль. Это относительно легкое соединение, то есть содержит небольшое количество частиц. Низкая молекулярная масса KCl позволяет легко транспортировать и использовать его в промышленных условиях.
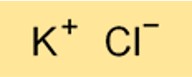
Структура KCl
Структура KCl представляет собой ионную кристаллическую решетку. Он состоит из чередующихся ионов калия и хлора, расположенных повторяющимся узором. Ионная природа структуры означает, что KCl является хорошим проводником электричества при растворении в воде.
| Появление | Белое кристаллическое твердое вещество |
| Удельный вес | 1,98 г/см³ |
| Цвет | От бесцветного до белого |
| Запах | Без запаха |
| Молярная масса | 74,55 г/моль |
| Плотность | 1,98 г/см³ |
| Точка плавления | 770°С (1418°Ф) |
| Точка кипения | 1420°С (2588°Ф) |
| Мигающая точка | Непригодный |
| Растворимость в воде | 34,7 г/100 мл (0°С) |
| Растворимость | Растворим в воде, глицерине и формамиде; слабо растворим в этаноле |
| Давление газа | Незначительный |
| Плотность пара | Непригодный |
| пКа | -1,8 (конъюгированная кислота) |
| рН | 7 (10% раствор) |
Хлорид калия: безопасность и опасности
Хлорид калия (KCl) представляет потенциальную опасность и проблемы безопасности, которые следует учитывать при обращении с ним или его использовании. Это может вызвать раздражение кожи и глаз, а длительное воздействие может привести к химическим ожогам. Вдыхание пыли KCl может вызвать раздражение дыхательных путей и кашель. Кроме того, употребление большого количества KCl может привести к электролитному дисбалансу и сердечным аритмиям. Важно носить соответствующие средства индивидуальной защиты, такие как перчатки и средства защиты глаз, и работать с KCl в хорошо проветриваемом помещении. При попадании на кожу или в глаза важно тщательно промыть пораженный участок и при необходимости обратиться к врачу.
| Символы опасности | Никто |
| Описание безопасности | Вызывает раздражение кожи и глаз. Вред при проглатывании. |
| ИН ID | ООН1480 |
| код ТН ВЭД | 310420 |
| Класс опасности | 5.1 |
| Группа упаковки | II |
| Токсичность | LD50 (крыса, перорально): 2500 мг/кг. |
Методы синтеза хлорида калия
Хлорид калия (KCl) можно синтезировать несколькими методами, в том числе:
- Солюбилизация и кристаллизация. Этот метод включает растворение KCl в воде, а затем испарение раствора, оставляя после себя твердые кристаллы KCl.
- Ионный обмен: для получения KCl ионы в растворе другой соли, например хлорида натрия, можно заменить ионами калия. Промышленность обычно использует этот метод при производстве удобрений KCl.
- Электролиз. При электролизе раствора KCl образуются элементарный калий и газообразный хлор, которые в сочетании образуют KCl.
- Реакция гидроксида калия с соляной кислотой : Гидроксид калия может реагировать с соляной кислотой с образованием KCl и воды.
- Реакция карбоната калия с соляной кислотой: Карбонат калия может реагировать с соляной кислотой с образованием KCl, диоксида углерода и воды.
Каждый метод имеет свои преимущества и недостатки, и выбор метода может зависеть от таких факторов, как требуемая чистота продукта, масштаб производства, стоимость сырья и оборудования.
Использование хлорида калия
Хлорид калия имеет широкий спектр применения, в том числе:
- Удобрение: используется в качестве удобрения для обеспечения необходимых питательных веществ для роста растений.
- Пищевая добавка: используется вместо соли в обработанных пищевых продуктах для снижения потребления натрия.
- Водоочистка: добавляется в системы очистки воды для предотвращения коррозии и образования накипи.
- Медицинское применение: используется во внутривенных жидкостях и растворах для пероральной регидратации для замены электролитов и лечения таких состояний, как гипокалиемия.
- Промышленное применение: используется в производстве стекла, керамики и мыла, а также в качестве сырья при производстве других химикатов.
- Корм для животных: добавляется в корм для животных для обеспечения необходимыми питательными веществами.
- Противообледенительный агент: используется в качестве противообледенительного средства для растапливания льда и снега на дорогах и тротуарах.
- Бурение нефти и газа: используется в качестве стабилизатора глины при бурении нефти и газа.
- Лабораторный реагент: используется в качестве реагента в лабораторных экспериментах и анализах.
Вопросы:
Вопрос: Что такое хлорид калия?
Ответ: Хлорид калия (KCl) представляет собой белую кристаллическую соль, состоящую из ионов калия и хлора. Он имеет множество применений в таких отраслях, как сельское хозяйство, пищевая промышленность, медицина и химическое производство.
Вопрос: Для чего используется хлорид калия?
Ответ: Хлорид калия обычно используется в качестве удобрения, пищевой добавки и в медицинских целях для лечения таких состояний, как гипокалиемия. Его также можно использовать при очистке воды, промышленных процессах, кормлении животных, борьбе с обледенением, бурении нефти и газа и лабораторных экспериментах.
Вопрос: Безопасен ли хлорид калия?
Ответ: Хлорид калия может быть вредным при проглатывании в больших количествах или при попадании в глаза или на кожу. Важно соблюдать соответствующие правила и правила техники безопасности при обращении или использовании хлорида калия.
Вопрос: Растворим ли KCl в воде?
Ответ: Да, KCl хорошо растворяется в воде. При комнатной температуре один грамм KCl растворяется в 1,5 мл воды.
Вопрос: KCl ионный или ковалентный?
Ответ: KCl является ионным соединением, поскольку оно состоит из положительно заряженных ионов калия и отрицательно заряженных ионов хлорида, которые удерживаются вместе ионными связями.
Вопрос: KCl – это кислота или основание?
Ответ: Хлорид калия является нейтральным соединением и не является ни кислотой, ни основанием.
Вопрос: Является ли KCl сильным электролитом?
Ответ: Да, KCl является мощным электролитом, поскольку при растворении в воде он полностью диссоциирует на ионы калия и хлорида, обеспечивая электропроводность.
