Хлорид золота (AuCl3) — соединение, образующееся при соединении золота с хлором. Он используется в различных областях, включая золочение и в качестве катализатора в химических реакциях.
| Название ИЮПАК | Хлорид золота(III) |
| Молекулярная формула | AuCl3 |
| Количество CAS | 13453-07-1 |
| Синонимы | Хлорид золота, трихлорзолото, трихлорид золота |
| ИнЧИ | InChI=1S/3ClH.Au/h3*1H;/q;;;+3/p-3 |
Свойства хлорида золота
Формула хлорида золота
Формула трихлорида золота: AuCl3. Это химическое соединение, состоящее из одного атома золота (Au) и трех атомов хлора (Cl). Эта формула отражает стехиометрию элементов, присутствующих в трихлориде золота.
хлорид золота Молярная масса
Молярную массу трихлорида золота рассчитывают путем сложения атомных масс составляющих его элементов. Для трихлорида золота (AuCl3) молярная масса составляет примерно 303,33 г/моль. Это полезно для определения количества вещества в данном образце.
Температура кипения хлорида золота
Трихлорид золота имеет температуру кипения примерно 254°C (градусов Цельсия). При этой температуре соединение переходит из жидкого состояния в газообразное. Точка кипения указывает на температуру, при которой давление паров жидкости равняется атмосферному давлению.
Температура плавления хлорида золота
Температура плавления трихлорида золота составляет примерно 254°C (градусов Цельсия). Это температура, при которой твердая форма соединения превращается в жидкость. Понимание температуры плавления имеет важное значение в различных промышленных процессах.
Плотность хлорида золота г/мл
Плотность трихлорида золота составляет примерно 4,7 г/мл (грамм на миллилитр). Плотность – это мера массы единицы объема вещества. Относительно высокая плотность трихлорида золота делает его тяжелее воды.
Хлорид золота Молекулярный вес
Молекулярная масса трихлорида золота, также известная как молярная масса, составляет примерно 303,33 г/моль (грамм на моль). Это сумма атомных весов всех атомов соединения. Молекулярная масса имеет решающее значение в химических расчетах.
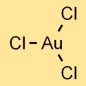
Структура хлорида золота
Трихлорид золота (AuCl3) имеет молекулярную структуру, состоящую из одного атома золота, связанного с тремя атомами хлора. Расположение образует плоскую треугольную форму с атомом золота в центре и окружающими его атомами хлора.
Растворимость хлорида золота
Трихлорид золота имеет ограниченную растворимость в воде. Он лучше растворяется в некоторых органических растворителях, таких как этанол и хлороформ. На растворимость трихлорида золота влияют такие факторы, как температура и природа растворителя.
| Появление | Желтое твердое вещество |
| Удельный вес | ~4,7 г/мл |
| Цвет | ЖЕЛТЫЙ |
| Запах | Без запаха |
| Молярная масса | ~303,33 г/моль |
| Плотность | ~4,7 г/мл |
| Точка плавления | ~254°С |
| Точка кипения | ~254°С |
| Мигающая точка | Непригодный |
| Растворимость в воде | Ограниченная растворимость |
| Растворимость | Растворим в некоторых органических растворителях, таких как этанол и хлороформ. |
| Давление газа | Нет в наличии |
| Плотность пара | Нет в наличии |
| пКа | Нет в наличии |
| рН | Нейтральный (pH 7) |
Безопасность и опасность хлорида золота
Трихлорид золота представляет потенциальную угрозу безопасности и требует осторожного обращения. Очень важно носить соответствующие защитные средства, такие как перчатки и защитные очки, чтобы избежать контакта с кожей и раздражения глаз. Следует избегать вдыхания его пыли или паров из-за возможных проблем с дыханием. Кроме того, воздействие высоких температур может привести к выделению токсичного газообразного хлора. Соединение также несовместимо с сильными восстановителями, что может привести к опасным реакциям. Для предотвращения несчастных случаев необходимы соответствующие меры по хранению, маркировке и локализации. Понимание этих опасностей и мер предосторожности имеет решающее значение при работе с трихлоридом золота в лабораторных или промышленных условиях.
| Символы опасности | Опасность |
| Описание безопасности | Обращаться осторожно. Избегайте контакта с кожей и глазами. Не вдыхайте пыль и пары. Беречь от сильных восстановителей. |
| Идентификационные номера ООН | Нет в наличии |
| код ТН ВЭД | 2843,29 |
| Класс опасности | 6.1 (Токсичные вещества) |
| Группа упаковки | II |
| Токсичность | Очень токсичен при проглатывании или вдыхании. Может вызвать раздражение кожи и глаз. |
Методы синтеза хлорида золота
Несколько методов позволяют синтезировать трихлорид золота.
Распространенный подход заключается в растворении золота или оксида золота в соляной кислоте (HCl) . В результате реакции образуются трихлорид золота и вода. Другой метод включает реакцию золота с газообразным хлором, в результате чего непосредственно образуется трихлорид золота. Альтернативно, газообразный хлор может реагировать с металлическим золотом в присутствии катализатора, такого как хлорид железа, с образованием трихлорида золота и хлорида железа в качестве побочных продуктов.
Другой путь синтеза включает взаимодействие металлического золота с царской водкой, смесью концентрированной азотной кислоты (HNO3) и соляной кислоты . Мощные окислительные свойства царской водки превращают золото в трихлорид золота, который можно выделить путем испарения. Трихлорид золота образуется при реакции соляной кислоты с оксидом золота (III) (Au2O3), в результате чего образуется трихлорид золота и вода.
Различные восстановители, такие как хлорид олова(II) (SnCl2) или диоксид серы (SO2), могут активно восстанавливать хлорид золота(V) (AuCl5) с получением трихлорида золота. В результате реакции образуются трихлорид золота и хлорид соответствующего восстановителя.
Каждый метод имеет свои преимущества и применимость в зависимости от доступного сырья и желаемой чистоты трихлорида золота. Тщательное рассмотрение условий реакции и мер безопасности имеет решающее значение в процессе синтеза.
Использование хлорида золота
Трихлорид золота находит разнообразное применение благодаря своим уникальным свойствам:
- Покрытие золотом: трихлорид золота служит источником ионов золота для процессов гальваники, позволяя наносить тонкий слой золота на поверхности. Это улучшает проводимость и обеспечивает привлекательную, устойчивую к коррозии поверхность.
- Катализатор: Трихлорид золота действует как катализатор в различных химических реакциях, особенно в органическом синтезе. Его способность активировать определенные связи делает его ценным для стимулирования определенных реакций.
- Медицина: Исследователи изучили возможности потенциального терапевтического применения соединений трихлорида золота при лечении артрита и других воспалительных заболеваний.
- Фотография. В фотографии трихлорид золота используется в качестве тонера, придающего черно-белым отпечаткам фиолетовый и коричневый цвета.
- Стекло и керамика. Стекольная промышленность использует трихлорид золота для производства рубинового стекла, придающего ему красный цвет, а керамика получает выгоду от его использования для усиления окраски.
- Нанотехнологии: Трихлорид золота играет решающую роль в нанотехнологиях, способствуя синтезу наночастиц золота, которые находят применение в электронике, катализе и медицинской визуализации.
- Антибактериальный агент: наночастицы трихлорида золота зарекомендовали себя как антибактериальные агенты, эффективно подавляющие рост некоторых бактерий.
- Сохранение произведений искусства. При реставрации произведений искусства эксперты используют трихлорид золота для позолоты и воссоздания исторических пигментов.
- Лабораторный реагент: ученые используют его в качестве лабораторного реагента для различных химических анализов и исследовательских целей.
- Металлические чернила. Производители используют чернила на основе трихлорида золота для печати, придавая нотку роскоши таким продуктам, как канцелярские товары и упаковка.
Благодаря своей универсальности и уникальным свойствам трихлорид золота продолжает оставаться актуальным в различных отраслях промышленности, играя важную роль в технике, искусстве, медицине и материаловедении.
Вопросы:
Вопрос: Какое химическое вещество можно использовать для осаждения золота из хлорида золота?
Ответ: Метабисульфит натрия (Na2S2O5) можно использовать в качестве восстановителя для осаждения золота из растворов трихлорида золота.
Вопрос: Содержится ли одноатомное золото в хлориде золота?
Ответ: Нет, одноатомное золото не является трихлоридом золота; это особая форма золота, состоящая из отдельных атомов, а не в сложном состоянии.
Вопрос: Какова молярная масса хлорида золота III?
A: Молярная масса трихлорида золота III (AuCl3) составляет примерно 303,33 г/моль.
Вопрос: Что такое хлорид золота?
Ответ: Трихлорид золота (AuCl3) представляет собой химическое соединение, образующееся в результате соединения золота с хлором и используемое в различных областях, таких как золочение и катализ.
Вопрос: Как приготовить хлорид олова для проверки на золото?
Ответ: Хлорид олова (SnCl2) можно получить растворением металлического олова в соляной кислоте (HCl) с последующим восстановлением.
Вопрос: Какова молярная масса AuCl3?
A: Молярная масса AuCl3 (трихлорид золота III) составляет примерно 303,33 г/моль.
Вопрос: Каков процент золота в AuCl3?
Ответ: Процент золота в AuCl3 составляет примерно 42,49%.
Вопрос: Сколько молей H2O содержится в 3,4 г AuCl3 · 2 H2O?
Ответ: В 3,4 г AuCl3 · 2 H2O содержится 0,0349 моль H2O.
Вопрос: Растворим ли AuCl3 в воде?
Ответ: Да, AuCl3 (трихлорид золота III) в некоторой степени растворим в воде.
Вопрос: Сколько граммов золота можно получить из 35 г AuCl3?
Ответ: Из 35 г AuCl3 можно извлечь около 14,87 граммов золота.
Вопрос: Какова молярная растворимость AuCl3? Ксп = 3,2 × 10−25
A: Молярная растворимость AuCl3 при Ksp = 3,2 × 10–25 составляет примерно 1,8 × 10^-9 моль/л.
