Хлорат натрия – химическое соединение формулы NaClO3. Это мощный окислитель, обычно используемый в производстве спичек, красителей и гербицидов.
| Название ИЮПАК | Хлорат натрия |
| Молекулярная формула | NaClO3 |
| Количество CAS | 7775-09-9 |
| Синонимы | Хлорная кислота, натриевая соль; Накло3; Хлорная кислота, натриевая соль (1:1); ООН1495; хлорат натрия; Хлорид натрия; |
| ИнЧИ | InChI=1S/ClHO3.Na/c2-1(3)4;/h(H,2,3,4);/q;+1/p-1 |
Свойства хлората натрия
Формула хлората натрия
Химическая формула хлората натрия: NaClO3. Это ионное соединение, состоящее из одного иона Na+ и одного иона ClO3-. Ион Na+ имеет положительный заряд, а ион ClO3- — отрицательный. Формула указывает на то, что ион Na+ соединяется с ионом ClO3-, образуя соединение.
Хлорат натрия Молярная масса
Молярная масса NaClO3 составляет 106,44 г/моль. Это масса одного моля соединения, содержащего число молекул Авогадро (6,022 х 10^23). Его рассчитывают путем сложения атомных масс всех атомов соединения.
Температура кипения хлората натрия
Температура кипения NaClO3 составляет 300°C (572°F). Это температура, при которой соединение переходит из жидкого состояния в газообразное. Температура кипения определяется силой межмолекулярных сил между молекулами.
Температура плавления хлората натрия
Температура плавления NaClO3 составляет 248°C (478°F). Это температура, при которой соединение переходит из твердого состояния в жидкое. Температура плавления определяется силой межмолекулярных сил между молекулами.
Плотность хлората натрия г/мл
Плотность NaClO3 составляет 2,49 г/мл. Это масса соединения в единице объема. Плотность определяется массой и объемом вещества.
Хлорат натрия Молекулярный вес
Молекулярная масса NaClO3 составляет 106,44 г/моль. Это сумма атомных весов всех атомов соединения.
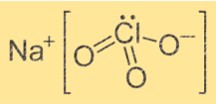
Структура хлората натрия
Структура NaClO3 кристаллическая. Ион Na+ окружен шестью атомами кислорода шести разных ионов ClO3-. Ионы ClO3- образуют тетраэдрическую форму вокруг иона Na+. Структура удерживается за счет ионных связей между ионом Na+ и ионами ClO3-.
Растворимость хлората натрия
NaClO3 растворим в воде, этаноле и метаноле. Он легко растворяется в воде, образуя прозрачный бесцветный раствор. Растворимость NaClO3 в воде увеличивается с температурой. При 20°С растворимость составляет 85 г/100 мл воды.
| Появление | Белый твердый |
| Удельный вес | 2,49 г/см³ |
| Цвет | Белый |
| Запах | Без запаха |
| Молярная масса | 106,44 г/моль |
| Плотность | 2,49 г/мл |
| Точка плавления | 248°С (478°Ф) |
| Точка кипения | 300°С (572°Ф) |
| Мигающая точка | Непригодный |
| Растворимость в воде | 85г/100мл |
| Растворимость | Растворим в воде, этаноле и метаноле. |
| Давление газа | Непригодный |
| Плотность пара | Непригодный |
| пКа | Непригодный |
| рН | Нейтральный (7) |
Безопасность и опасность хлората натрия
NaClO3 является сильным окислителем, поэтому с ним следует обращаться осторожно. Существует потенциальный риск возгорания и взрыва при контакте с органическими материалами, такими как бумага, дерево или масло. Он также может бурно реагировать с восстановителями, кислотами и металлическими порошками. Проглатывание или вдыхание NaClO3 может вызвать серьезные последствия для здоровья, такие как проблемы с дыханием, боли в животе и рвота. NaClO3 также может раздражать кожу, глаза и дыхательную систему. При работе с NaClO3 следует носить соответствующее защитное оборудование, включая перчатки, очки и респиратор, чтобы избежать воздействия и потенциальных опасностей.
| Символы опасности | Окислитель |
| Описание безопасности | Вреден при проглатывании, вызывает серьезное раздражение глаз, может вызвать раздражение дыхательных путей. |
| Идентификационные номера ООН | ООН 1495 |
| код ТН ВЭД | 2829.19.00 |
| Класс опасности | 5.1 (Окисляющие материалы) |
| Группа упаковки | II |
| Токсичность | Токсично при проглатывании или вдыхании, раздражает кожу и глаза. |
Методы синтеза хлората натрия
Существует несколько методов синтеза NaClO3.
Распространенным методом является электролиз раствора хлорида натрия . При этом через раствор пропускают электрический ток, в результате чего хлорид натрия распадается на NaClO3 и газообразный хлор. Другой метод включает реакцию гидроксида натрия с газообразным хлором с образованием NaClO3 и хлорида натрия.
Третий метод включает реакцию карбоната натрия с газообразным хлором в присутствии катализатора. При этом образуется NaClO3, хлорид натрия и углекислый газ. В качестве альтернативы реакция между гипохлоритом натрия и гидроксидом натрия может привести к образованию NaClO3. В результате реакции образуются NaClO3, хлорид натрия и вода.
Помимо этих способов, NaClO3 можно также получить реакцией хлорита натрия с перекисью водорода. В результате этой реакции образуются NaClO3, вода и газообразный кислород.
Использование хлората натрия
NaClO3 находит различное применение в различных отраслях промышленности. Некоторые из его распространенных применений включают в себя:
- Гербицид: широко используется в качестве гербицида, особенно для борьбы с сорняками на невозделываемых территориях, таких как обочины дорог, железнодорожные пути и линии электропередач. Нарушая фотосинтез растений, он может эффективно бороться с различными сорняками.
- Отбеливатель: используется в целлюлозно-бумажной промышленности в качестве отбеливателя. Он особенно эффективен при производстве высококачественной ярко-белой бумаги.
- Горное дело: Используется в горнодобывающей промышленности в качестве окислителя при добыче золота и других драгоценных металлов.
- Взрывчатые вещества: используются в качестве ингредиента при производстве взрывчатых веществ, таких как динамит и хлорат аммония.
- Красители и пигменты: используются при производстве красителей и пигментов, особенно для окраски текстиля.
- Лаборатория: Используется в лаборатории в качестве реагента для различных химических реакций.
- Очистка воды: используется при очистке воды для контроля роста водорослей и в качестве дезинфицирующего средства.
- Пищевой консервант: также используется в качестве пищевого консерванта для продления срока годности определенных продуктов.
Вопросы:
Вопрос: Как сделать хлорат натрия?
Ответ: NaClO3 можно получить несколькими методами, такими как электролиз раствора хлорида натрия, реакция гидроксида натрия с газообразным хлором и реакция карбоната натрия с газообразным хлором в присутствии катализатора.
Вопрос: Сколько времени нужно хлорату натрия, чтобы уничтожить сорняки?
Ответ: NaClO3 является мощным гербицидом и может уничтожить сорняки в течение нескольких дней после применения. Время, необходимое для уничтожения сорняков, может варьироваться в зависимости от таких факторов, как концентрация используемого NaClO3 и тип целевых сорняков.
Вопрос: Является ли хлорат натрия чистым веществом?
Ответ: Да, NaClO3 — чистое вещество, поскольку это соединение, состоящее только из атомов натрия, хлора и кислорода.
Вопрос: Растворим ли хлорат натрия в воде?
Ответ: Да, NaClO3 хорошо растворяется в воде. Он может растворяться в воде с образованием прозрачного бесцветного раствора.
Вопрос: Сколько атомов кислорода содержится в молекуле хлората натрия?
Ответ: Молекула NaClO3 имеет три атома кислорода. Его химическая формула – NaClO3.
Вопрос: Является ли хлорат натрия ионным или ковалентным?
Ответ: NaClO3 — ионное соединение. Он образуется в результате переноса электронов от атомов натрия к атомам хлора с образованием положительно заряженных ионов Na+ и отрицательно заряженных ионов NaClO3.
