Хлорат кальция (Ca(ClO3)2) — химическое соединение, состоящее из кальция, хлора и кислорода. Его обычно используют в качестве окислителя в фейерверках и спичках. Его также можно использовать для стерилизации оборудования в пищевой промышленности.
| Название ИЮПАК | Хлорат кальция |
| Молекулярная формула | Са(ClO3)2 |
| Количество CAS | 10137-74-3 |
| Синонимы | Хлорная кислота, кальциевая соль; Гидратированный хлорат кальция; перхлорат кальция; Кальциохлорит; ООН1456 |
| ИнЧИ | InChI=1S/Ca.2ClHO3/c;2 2-1(3)4/h;2 (H,2,3,4)/q+2;;/p-2 |
Свойства хлората кальция
Формула хлората кальция
Формула хлората кальция: Ca(ClO3)2. Он состоит из одного иона Ca2+ и двух ионов ClO3-. Хлорат кальция является ионным соединением, то есть он удерживается вместе за счет электростатического притяжения между положительными и отрицательными ионами.
хлорат кальция Молярная масса
Молярная масса Ca(ClO3)2 составляет 206,98 г/моль. Это можно рассчитать, сложив атомные массы кальция, хлора и кислорода, входящих в состав соединения. Молярная масса важна для расчета количества Ca(ClO3)2, необходимого для данной реакции.
Температура кипения хлората кальция
Ca(ClO3)2 не имеет точки кипения, поскольку он разлагается, не достигнув точки кипения. При нагревании Ca(ClO3)2 разлагается на хлорид кальция (CaCl2) и газообразный кислород (O2). Это разложение является экзотермическим и может быть опасным, если с ним не обращаться должным образом.
Хлорат кальция Температура плавления
Температура плавления Ca(ClO3)2 составляет 135°С. Это температура, при которой твердое соединение переходит из твердого состояния в жидкое. Ca(ClO3)2 представляет собой белое кристаллическое твердое вещество при комнатной температуре и давлении.
Плотность хлората кальция г/мл
Плотность Ca(ClO3)2 составляет 2,4 г/мл. Это означает, что один миллилитр Ca(ClO3)2 весит 2,4 грамма. Плотность – это мера плотности молекул в веществе. Ca(ClO3)2 плотнее воды, плотность которой составляет 1 г/мл.
Хлорат кальция Молекулярный вес
Молекулярная масса Ca(ClO3)2 составляет 206,98 г/моль. Она равна молярной массе и может быть рассчитана путем сложения атомных масс отдельных элементов в соединении.
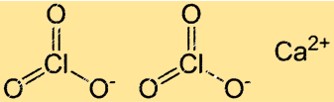
Структура хлората кальция
Ca(ClO3)2 имеет структуру кристаллической решетки, типичную для ионных соединений. В этой структуре ионы Ca2+ и ClO3- расположены регулярно, повторяясь. Каждый ион Ca2+ окружен шестью ионами ClO3-, а каждый ион хлората окружен шестью ионами кальция.
Растворимость хлората кальция
Ca(ClO3)2 растворим в воде и образует прозрачный бесцветный раствор. Растворимость Ca(ClO3)2 в воде увеличивается с температурой. Однако он менее растворим в органических растворителях, таких как этанол и ацетон. Ca(ClO3)2 также гигроскопичен, то есть поглощает влагу из воздуха. Это может привести к тому, что состав со временем намокнет или растворится.
| Появление | Белое кристаллическое твердое вещество |
| Удельный вес | 2.4 |
| Цвет | Бесцветный |
| Запах | Без запаха |
| Молярная масса | 206,98 г/моль |
| Плотность | 2,4 г/мл |
| Точка плавления | 135°С |
| Точка кипения | Разлагается до точки кипения |
| Мигающая точка | Непригодный |
| Растворимость в воде | Растворимый |
| Растворимость | Растворим в воде, менее растворим в органических растворителях. |
| Давление газа | Непригодный |
| Плотность пара | Непригодный |
| пКа | Непригодный |
| рН | Непригодный |
Безопасность и опасность хлората кальция
Ca(ClO3)2 считается опасным веществом, и с ним следует обращаться осторожно. Это окислитель, который может бурно реагировать с органическими материалами, вызывая пожары и взрывы. Вдыхание или проглатывание Ca(ClO3)2 может вызвать раздражение дыхательных путей и желудочно-кишечного тракта. Длительное воздействие может вызвать раздражение кожи, ожоги и возможные аллергические реакции. При работе с Ca(ClO3)2 важно носить соответствующие средства индивидуальной защиты, включая перчатки, очки и респиратор. В случае воздействия немедленно обратитесь за медицинской помощью. Храните Ca(ClO3)2 в прохладном, сухом, хорошо проветриваемом месте вдали от несовместимых веществ.
| Символы опасности | О, Хн |
| Описание безопасности | Хранить вдали от органических материалов. Носите средства индивидуальной защиты. Хранить в прохладном, сухом, хорошо проветриваемом месте. |
| Идентификационные номера ООН | ООН1458 |
| код ТН ВЭД | 2829.11.00 |
| Класс опасности | 5.1 |
| Группа упаковки | II |
| Токсичность | Токсично при проглатывании или вдыхании. Может вызвать раздражение кожи и глаз. Может вызвать раздражение дыхательных путей. |
Методы синтеза хлората кальция
Для синтеза Ca(ClO3)2 можно использовать разные методы.
Распространенный метод включает реакцию гидроксида кальция с газообразным хлором. В этом процессе сначала образуется хлорид кальция как побочный продукт, который реагирует с оставшимся хлором с образованием Ca(ClO3)2.
Другой метод включает реакцию карбоната кальция с азотной кислотой и газообразным хлором. Для получения Ca(ClO3)2 полученный раствор упаривают и кристаллизуют.
Другой подход предполагает электролиз раствора, содержащего хлорид кальция и хлорат натрия. Конечными продуктами этого процесса являются Ca(ClO3)2 и хлорид натрия.
В результате реакции гипохлорита кальция и хлората натрия образуется Ca(ClO3)2, который затем очищается и кристаллизуется.
Использование хлората кальция
Ca(ClO3)2 имеет несколько важных применений в различных отраслях промышленности. Вот некоторые из наиболее распространенных применений Ca(ClO3)2:
- Отбеливатель: используется в качестве отбеливателя в целлюлозно-бумажной промышленности.
- Фейерверки: окислитель, обычно используемый при производстве фейерверков.
- Спички: также используются при производстве безопасных спичек, поскольку их легко воспламенить.
- Гербициды: используются в качестве гербицида, поскольку могут избирательно уничтожать определенные сорняки, не нанося вреда сельскохозяйственным культурам.
- Окислитель: используется в качестве окислителя при производстве других химикатов, таких как перхлораты и хлораты.
- Фармацевтика: также используется при производстве фармацевтических продуктов, таких как противоинфекционные препараты.
- Лабораторный реагент: используется в качестве лабораторного реагента для аналитической химии.
- Производство пигментов: используется при производстве пигментов, таких как синий ультрамарин.
Вопросы:
Вопрос: Какова формула хлората кальция?
Ответ: Химическая формула хлората кальция: Ca(ClO3)2.
Вопрос: Для чего используется хлорат кальция?
Ответ: Ca(ClO3)2 имеет различные применения в промышленности, например, в качестве отбеливателя в целлюлозно-бумажной промышленности, окислителя при производстве других химикатов, гербицидов, производственных пигментов и лабораторных реагентов.
Вопрос: Является ли хлорат кальция твердым веществом?
Ответ: Да, Ca(ClO3)2 является твердым веществом при комнатной температуре.
Вопрос: Где чаще всего встречается хлорат натрия и для чего используется хлорат кальция?
Ответ: Хлорат натрия чаще всего встречается в химической промышленности, где он используется в качестве окислителя и гербицида. Ca(ClO3)2 же используется в качестве отбеливателя, окислителя и гербицида в различных отраслях промышленности.
Вопрос: Каково общее количество атомов в соединении Ca(ClO3)2?
A: Соединение Ca(ClO3)2 содержит в общей сложности 13 атомов: 1 атом кальция, 2 атома хлора и 6 атомов кислорода от двух ионов ClO3-.
Вопрос: Какова массовая доля хлора в Ca(ClO3)2?
A: Атомная масса хлора составляет 35,5 г/моль, а молярная масса Ca(ClO3)2 составляет 238,98 г/моль. Следовательно, массовая доля хлора в Ca(ClO3)2 равна (2 х 35,5 г/моль) / 238,98 г/моль х 100 % = 29,68 %.
Вопрос: Сколько атомов хлора в Ca(ClO3)2?
Ответ: В Ca(ClO3)2 есть два атома хлора, представленные двумя группами ClO3.
Вопрос: Какова масса каждого соединения в исходной смеси Ca(ClO3)2 и Ca(ClO)2?
Ответ: Невозможно определить массу каждого соединения в исходной смеси без дополнительной информации, такой как общая масса или соотношение масс между двумя соединениями.
