Фторид цинка (ZnF2) — химическое соединение. Он состоит из цинка и фтора. Благодаря своим уникальным свойствам он используется в различных отраслях промышленности, таких как стоматология и электроника.
| Название ИЮПАК | фторид цинка |
| Молекулярная формула | ZnF2 |
| Количество CAS | 7783-49-5 |
| Синонимы | Дифторид цинка, фторид цинка(II) |
| ИнЧИ | InChI=1S/2FH.Zn/h2*1H;/q;;+2/p-2 |
Свойства фторида цинка
Формула фторида цинка
Химическая формула дифторида цинка: ZnF2. Эта формула означает, что каждая молекула дифторида цинка состоит из одного атома цинка (Zn) и двух атомов фтора (F).
фторид цинка Молярная масса
Молярная масса дифторида цинка (ZnF2) составляет примерно 103,38 г/моль. Это значение рассчитывается путем сложения атомных масс одного атома цинка и двух атомов фтора.
Температура кипения фторида цинка
Дифторид цинка имеет температуру кипения примерно 872°C (1602°F). Это температура, при которой соединение переходит из жидкого состояния в газообразное при стандартном атмосферном давлении.
Фторид цинка Температура плавления
Температура плавления дифторида цинка составляет примерно 872°C (1602°F). При этой температуре твердая форма дифторида цинка превращается в жидкость.
Плотность фторида цинка г/мл
Плотность дифторида цинка составляет примерно 4,95 г/мл. Это значение представляет собой массу соединения на единицу объема и указывает на его тяжесть.
Молекулярный вес фторида цинка
Молекулярная масса дифторида цинка (ZnF2) составляет примерно 103,38 г/моль. Это значение представляет собой сумму атомных весов всех атомов в молекуле соединения.
Структура фторида цинка
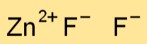
Дифторид цинка (ZnF2) имеет кристаллическую структуру, в которой каждый атом цинка окружен четырьмя ионами фторида, расположенными в тетраэдрическом порядке. Такое расположение способствует стабильности соединения.
Растворимость фторида цинка
Дифторид цинка демонстрирует ограниченную растворимость в воде. Он плохо растворим, то есть лишь небольшое количество соединения может раствориться в воде с образованием раствора. Эта характеристика важна для различных промышленных применений и химических процессов.
| Появление | Белый твердый |
| Удельный вес | 4,95 г/см³ |
| Цвет | Бесцветный |
| Запах | Без запаха |
| Молярная масса | 103,38 г/моль |
| Плотность | 4,95 г/мл |
| Точка плавления | 872°С (1602°Ф) |
| Точка кипения | 872°С (1602°Ф) |
| Мигающая точка | Непригодный |
| Растворимость в воде | Ограниченная растворимость |
| Растворимость | Плохо растворим, лишь небольшое количество растворяется в воде. |
| Давление газа | Не четко определено |
| Плотность пара | Не четко определено |
| пКа | Непригодный |
| рН | Нейтральный |
Безопасность и опасность фторида цинка
Дифторид цинка (ZnF2) вызывает определенные соображения безопасности. Важно обращаться с этим соединением осторожно. Избегайте вдыхания или проглатывания, так как это может вызвать раздражение дыхательных путей и желудочно-кишечного тракта. При работе с ZnF2 надевайте соответствующие средства индивидуальной защиты, такие как перчатки и защитные очки, чтобы избежать контакта с кожей и глазами. В случае случайного контакта промойте пораженные участки большим количеством воды. Храните дифторид цинка вдали от несовместимых материалов и источников тепла. Хотя он не очень токсичен, разумно следовать надлежащим процедурам обращения и обеспечить хорошую вентиляцию, чтобы свести к минимуму потенциальные риски, связанные с его использованием.
| Символы опасности | Разъедающее, Раздражающее, Острая токсичность |
| Описание безопасности | Обращаться осторожно. Избегайте вдыхания и проглатывания. Носите защитное снаряжение. |
| Идентификационные номера ООН | Непригодный |
| код ТН ВЭД | 28261900 |
| Класс опасности | Неклассифицированный |
| Группа упаковки | Непригодный |
| Токсичность | Низкая токсичность |
Методы синтеза фторида цинка
Дифторид цинка можно синтезировать различными методами. Распространенный подход включает реакцию между оксидом цинка (ZnO) и плавиковой кислотой (HF) . В этом методе ZnO смешивается с HF, в результате чего образуются дифторид цинка и вода. Другой метод включает реакцию между карбонатом цинка (ZnCO3) и плавиковой кислотой. Карбонат цинка реагирует с HF с образованием дифторида цинка, диоксида углерода и воды.
Кроме того, дифторид цинка также можно получить путем реакции металлического цинка с газообразным фтором (F2) при высоких температурах. В результате этой реакции непосредственно образуется дифторид цинка с выделением тепла.
Кроме того, можно использовать методы осаждения, при которых растворимые соли цинка реагируют с растворимыми солями фторида с образованием нерастворимого дифторида цинка, который затем можно отделить и собрать.
Важно проявлять осторожность во время этих процессов синтеза из-за реакционной способности задействованных химических веществ. Для обеспечения успешного и безопасного синтеза дифторида цинка необходимо использовать соответствующие меры безопасности и оборудование.
Использование фторида цинка
Дифторид цинка (ZnF2) благодаря своим уникальным свойствам находит универсальное применение в различных отраслях промышленности. Вот его основные применения:
- Уход за зубами: укрепите зубную эмаль и улучшите гигиену полости рта за счет включения ZnF2 в составы зубных паст.
- Оптика и покрытия: Улучшите антибликовые свойства линз и улучшите светопропускание за счет использования ZnF2 в оптических покрытиях.
- Электроника: интегрируйте ZnF2 в дисплеи на тонкопленочных транзисторах (TFT) для создания прозрачных проводящих пленок.
- Источник фторид-ионов: используйте ZnF2 в качестве источника фторид-ионов в электролитических ячейках, чтобы производить химически активные металлы, такие как алюминий.
- Химический синтез: используйте ZnF2 в качестве катализатора и фторирующего агента в различных химических реакциях для облегчения синтеза фармацевтических препаратов и агрохимикатов.
- Гальванизация: нанесите ZnF2 в процессе отделки металла на металлические поверхности, готовые к гальванизации, чтобы улучшить адгезию и долговечность.
- Инфракрасные окна: изготовьте окна с инфракрасными датчиками и тепловизионные системы с использованием ZnF2 из-за его прозрачности в инфракрасной области.
- Применение лазеров: используйте ZnF2 в качестве усиливающей среды для лазеров, чтобы внести вклад в разработку перестраиваемых лазеров для научных и промышленных целей.
- Выращивание кристаллов: включите ZnF2 в процессы выращивания кристаллов полупроводников и других электронных компонентов.
- Химические исследования: используйте ZnF2 в качестве реагента и реагента в различных химических реакциях лабораторного масштаба, что облегчает исследование новых соединений.
Эти разнообразные применения подчеркивают важность дифторида цинка в современных технологиях, производстве и научных исследованиях во многих областях.
Вопросы:
Вопрос: Какова химическая формула фторида цинка?
Ответ: Химическая формула дифторида цинка — ZnF2.
Вопрос: Какова формула фторида цинка (II)?
Ответ: Формула дифторида цинка(II) — ZnF2.
Вопрос: Какова формула ионного соединения, образованного ионами цинка и фторида?
A: Формула ионного соединения, образованного из ионов Zn+2 и фторида, — ZnF2.
Вопрос: Что может произойти из-за дефицита цинка, йода или фтора?
Ответ: Дефицит цинка, йода или фтора может привести к множеству проблем со здоровьем, влияя на обмен веществ, функцию щитовидной железы и здоровье зубов.
Вопрос: Что из перечисленного не имеет RDA? А. железо Б. цинк в. йод д. фторид
Ответ: Рекомендуемая норма потребления фторида (RDA) отсутствует.
Вопрос: Как фторид цинка может повлиять на человека?
Ответ: Дифторид цинка может повлиять на человека при проглатывании, вдыхании или потенциальном контакте с кожей, что может вызвать раздражение или токсичность.
Вопрос: ZnF2 ионный или молекулярный?
Ответ: ZnF2 — ионное соединение.
Вопрос: Почему это ZnF2, а не ZnF?
Ответ: ZnF2 указывает на то, что каждый атом Zn связан с двумя ионами F, образуя правильную стехиометрию.
Вопрос: Будут ли ZnF2 и NaOH образовывать осадок?
Ответ: Да, ZnF2 и NaOH могут образовывать белый осадок гидроксида цинка (Zn(OH)2).
Вопрос: Растворим ли ZnF2?
Ответ: ZnF2 плохо растворяется в воде.
Вопрос: Как называется соединение с формулой ZnF2?
Ответ: Соединение формулы ZnF2 называется дифторидом цинка.
Вопрос: Ksp ZnF2 составляет 3,0 × 10⁻² при 25°C. Что такое ΔG°?
A: Значение ΔG° можно рассчитать на основе заданного значения Ksp и температуры с использованием соответствующего термодинамического уравнения.
Вопрос: Что такое ZnF2?
Ответ: ZnF2 — это химическая формула дифторида цинка, соединения цинка и фтора.
Вопрос: Сколько молей в ZnF2?
A: Число молей в ZnF2 зависит от заданной массы и молярной массы соединения.
