Триоксид хрома, также известный как хромовая кислота, представляет собой неорганическое соединение формулы CrO3. Это кислотный ангидрид хромовой кислоты, который иногда продается под тем же названием.
| Название ИЮПАК | Оксид хрома(VI) |
| Молекулярная формула | CrO3 |
| Количество CAS | 1333-82-0 |
| Синонимы | Хромовый ангидрид, оксид хрома ангидрид, триоксохром Оксид хрома (VI) |
| ИнЧИ | ИнЧИ=1S/Cr.3O |
Свойства триоксида хрома
Формула триоксида хрома
Формула хромового ангидрида CrO3. Он состоит из одного атома хрома, связанного с тремя атомами кислорода.
триоксид хрома Молярная масса
Молярную массу хромового ангидрида рассчитывают путем сложения атомных масс составляющих его элементов: хрома (Cr) и кислорода (O). Молярная масса составляет приблизительно 99,994 г/моль.
Температура кипения триоксида хрома
Хромовый ангидрид не имеет четко выраженной точки кипения. При нагревании он разлагается на оксид хрома и газообразный кислород, не проходя через жидкую фазу.
Температура плавления триоксида хрома
Температура плавления хромового ангидрида составляет примерно 196°С. При этой температуре он переходит из твердого состояния в жидкое.
Плотность триоксида хрома г/мл
Плотность хромового ангидрида составляет примерно 2,7 г/мл. Это значение представляет собой массу соединения на единицу объема.
Молекулярный вес триоксида хрома
Молекулярная масса хромового ангидрида, также называемая молярной массой, составляет примерно 99,994 г/моль. Это сумма атомных масс атомов хрома и кислорода в соединении.
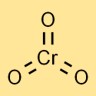
Структура триоксида хрома
Хромовый ангидрид имеет молекулярную структуру, в которой один атом хрома центрально связан с тремя атомами кислорода. Он имеет тетраэдрическую геометрию с атомом хрома в центре и атомами кислорода по углам.
Растворимость триоксида хрома
Хромовый ангидрид хорошо растворим в воде. Он легко растворяется, образуя раствор хромовой кислоты. Растворимость хромового ангидрида в воде позволяет использовать его в различных химических процессах и применениях.
| Появление | Темно-красные кристаллы |
| Удельный вес | 2,7 г/мл |
| Цвет | Темно-красный |
| Запах | Без запаха |
| Молярная масса | 99,994 г/моль |
| Плотность | 2,7 г/мл |
| Точка плавления | 196°С |
| Точка кипения | Разложившийся |
| Мигающая точка | Непригодный |
| Растворимость в воде | Очень растворим |
| Растворимость | Растворим в различных растворителях, таких как этанол, эфир и т. д. |
| Давление газа | Непригодный |
| Плотность пара | Непригодный |
| пКа | Непригодный |
| рН | Кислота (в растворе) |
Безопасность и опасность триоксида хрома
Хромовый ангидрид представляет значительную угрозу безопасности, и с ним следует обращаться осторожно. Это высококоррозионное и окисляющее вещество, способное вызвать сильные ожоги кожи, глаз и дыхательной системы. Вдыхание или проглатывание хромового ангидрида может вызвать расстройство дыхания, желудочно-кишечные проблемы и даже повреждение органов.
При работе с хромовым ангидридом следует использовать соответствующие средства индивидуальной защиты (СИЗ), включая перчатки, очки и респиратор. Его следует хранить в прохладном, сухом месте вдали от несовместимых материалов и источников возгорания.
Утилизация хромового ангидрида должна осуществляться в соответствии с местными правилами, поскольку он считается опасными отходами. Его не следует выпускать в окружающую среду.
| Символы опасности | Коррозионное, Окисляющее |
| Описание безопасности | Избегать попадания на кожу, в глаза и вдыхание. Используйте соответствующее защитное оборудование. |
| Идентификационные номера ООН | ООН 1463 |
| код ТН ВЭД | 2819.90.90 |
| Класс опасности | 5.1 (Окислитель) |
| Группа упаковки | II |
| Токсичность | Очень токсичен |
Методы синтеза триоксида хрома
Существует несколько методов синтеза хромового ангидрида.
Распространенный метод включает реакцию между дихроматом натрия и серной кислотой . В контролируемой среде кто-то смешивает дихромат натрия (Na2Cr2O7) с концентрированной серной кислотой (H2SO4) . В результате реакции образуется темно-красный раствор хромового ангидрида (CrO3) и сульфата натрия (Na2SO4) в качестве побочного продукта.
Другой метод включает окисление соединений хрома (III) с использованием сильных окислителей, таких как перекись водорода (H2O2) или азотная кислота (HNO3) . В этом процессе смешайте соединение хрома (III) с окислителем в определенных условиях, чтобы превратить хром (III) в хромовый ангидрид.
Хромовый ангидрид получают путем взаимодействия металлического хрома или соединений хрома(II) с сильными окислителями, такими как перманганат калия (KMnO4) или дихромат калия (K2Cr2O7). Реакция приводит к образованию хромового ангидрида.
Важно отметить, что синтез хромового ангидрида необходимо проводить с соблюдением соответствующих мер безопасности и с соблюдением соответствующих норм. Опытные специалисты должны проводить процесс синтеза в хорошо оборудованных лабораториях, чтобы обеспечить их безопасность и минимизировать воздействие на окружающую среду.
Использование триоксида хрома
Хромовый ангидрид находит применение в качестве окислителя в различных химических процессах, в том числе в производстве органических соединений.
- Производители используют его для производства красителей и пигментов, таких как желтый хром и зеленый хром.
- Гальваническая промышленность использует его для нанесения хрома на металлические поверхности, обеспечивая стойкость к коррозии и привлекательный внешний вид.
- Его используют при приготовлении хромовых катализаторов реакций полимеризации в производстве пластмасс и синтетических материалов.
- Он играет роль в синтезе фармацевтических препаратов и органических промежуточных продуктов.
- При консервировании древесины он используется в качестве фунгицида и инсектицида для защиты от гниения и вредителей.
- Лаборатории используют его в качестве реагента для различных химических тестов и анализов.
- Его использование в производстве специализированного стекла и керамики улучшает цвета и особые свойства.
- В кожевенной промышленности его используют для обработки кожи, помогая стабилизировать и покрасить шкуры.
- Он входит в состав чистящих средств и средств для обработки металлических поверхностей.
Важно обращаться с хромовым ангидридом с осторожностью из-за его токсичной и коррозионной природы. Соблюдение соответствующих протоколов безопасности обеспечивает защиту людей и окружающей среды при его использовании и утилизации.
Вопросы:
Вопрос: Что такое CrO3?
Ответ: CrO3 — хромовый ангидрид, соединение, состоящее из одного атома хрома, связанного с тремя атомами кислорода.
Вопрос: Является ли CrO3 сильным окислителем?
Ответ: Да, CrO3 — мощный окислитель, обычно используемый в химических реакциях для облегчения окисления различных соединений.
Вопрос: Что CrO3 делает с алкоголем?
Ответ: CrO3 может окислять спирты и превращать их в соответствующие карбонильные соединения, такие как альдегиды или кетоны.
Вопрос: Какой органический продукт вы получили бы при реакции пентанола-1 с CrO3, H2O и H2SO4?
Ответ: В результате реакции образуется органический продукт 1-пентанон, который представляет собой кетон.
Вопрос: Какой реагент лучше всего выбрать для выполнения следующего преобразования: PCC, HIO4, CrO3, NaOH?
Ответ: Лучшим реагентом для этого преобразования будет PCC (хлорхромат пиридиния).
Вопрос: Является ли CrO3 амфотерным?
Ответ: Нет, CrO3 не амфотерен. Это очень кислое соединение, но неспособное проявлять основные свойства.
Вопрос: Как найти степень окисления Cr в CrO3?
Ответ: Степень окисления Cr в CrO3 равна +6.
Вопрос: Как называется CrO3?
A: Название CrO3 — хромовый ангидрид.
Вопрос: Что CrO3 делает с неаноническими спиртами?
Ответ: CrO3 может окислять неанонные спирты, превращая их в соответствующие карбонильные соединения, такие как неанонные кетоны.
Вопрос: Каков заряд катиона переходного металла в CrO3?
Ответ: Катион переходного металла в CrO3, которым является хром, имеет заряд +6.
