Тринатрийфосфат (Na3PO4) представляет собой соединение, состоящее из ионов натрия и фосфата. Он находит различное применение в таких отраслях, как пищевая, фармацевтическая промышленность и производство моющих средств, благодаря своей способности контролировать кислотность и действовать как буфер.
| Название ИЮПАК | Тринатрийфосфат |
| Молекулярная формула | Na3PO4 |
| Количество CAS | 7601-54-9 |
| Синонимы | фосфат натрия, TSP, ортофосфат натрия, трехосновный фосфат натрия, третичный фосфат натрия, тринатрийортофосфат |
| ИнЧИ | InChI=1S/3Na.H3O4P/c;;;1-5(2,3)4/h;;;(H3,1,2,3,4)/q3*+1;/p-3 |
Свойства тринатрийфосфата
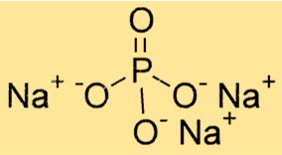
Формула тринатрийфосфата
Химическая формула тринатрийфосфата: Na3PO4. Он состоит из трех катионов натрия (Na+) и одного фосфат-аниона (PO43-). Формула важна для определения стехиометрии химических реакций и расчета количества вещества в заданном количестве.
Молярная масса тринатрийфосфата
Молярная масса Na3PO4 составляет 163,94 г/моль. Он рассчитывается путем сложения атомных масс составляющих его элементов: натрия, фосфора и кислорода. Молярная масса — важный параметр, используемый для определения количества вещества в заданном количестве. Он также используется для расчета стехиометрии химических реакций.
Тринатрийфосфат Температура кипения
Температура кипения Na3PO4 составляет 1587°С. Это температура, при которой жидкое состояние переходит в газообразное. Температура кипения вещества зависит от различных факторов, таких как давление, температура и межмолекулярные силы. Высокая температура кипения Na3PO4 обусловлена его ионной природой и сильными межмолекулярными силами.
Температура плавления тринатрийфосфата
Температура плавления Na3PO4 составляет 1340°С. Это температура, при которой твердое вещество переходит в жидкое состояние. Температура плавления вещества зависит от различных факторов, таких как давление, температура и межмолекулярные силы. Высокая температура плавления Na3PO4 обусловлена его ионной природой и сильными межмолекулярными силами.
Тринатрийфосфат Плотность г/мл
Плотность Na3PO4 составляет 2,54 г/мл. Плотность – это мера массы вещества в единице объема. Это важное физическое свойство вещества, используемое для определения его массы или объема. Высокая плотность Na3PO4 обусловлена его ионной природой и плотно упакованными частицами.
Молекулярный вес тринатрийфосфата
Молекулярная масса Na3PO4 составляет 163,94 г/моль. Это сумма атомных весов всех атомов молекулы. Молекулярная масса Na3PO4 важна для определения стехиометрии химических реакций и расчета количества вещества в заданном количестве.
Структура тринатрийфосфата
Na3PO4 имеет кристаллическую структуру с гексагональным расположением плотноупакованных атомов. Катионы натрия располагаются в междоузлиях компактных анионов кислорода. Фосфат-анион состоит из одного атома фосфора и четырех атомов кислорода, расположенных в тетраэдрической форме.
| Появление | Белый кристаллический порошок |
| Удельный вес | 2536 г/см3 |
| Цвет | От бесцветного до белого |
| Запах | Без запаха |
| Молярная масса | 163,94 г/моль |
| Плотность | 2,54 г/мл |
| Точка плавления | 1340°С |
| Точка кипения | 1587°С |
| Мигающая точка | Непригодный |
| Растворимость в воде | Очень растворим |
| Растворимость | Растворим в воде и нерастворим в органических растворителях. |
| Давление газа | Непригодный |
| Плотность пара | Непригодный |
| пКа | рКа1 = 2,15, рКа2 = 7,20, рКа3 = 12,35 |
| рН | pH 0,1 М раствора = 11,5. |
Безопасность и опасность тринатрийфосфата
Na3PO4 обычно считается безопасным для использования в пищевых продуктах, фармацевтических препаратах и других целях. Однако, как и любое химическое вещество, при неправильном обращении он может представлять опасность. Проглатывание большого количества Na3PO4 может привести к желудочно-кишечным проблемам, таким как диарея, тошнота и рвота. Контакт вещества с глазами и кожей может вызвать раздражение и ожоги. Важно обращаться с Na3PO4 осторожно, носить соответствующие средства индивидуальной защиты и соблюдать все меры безопасности при работе с этим веществом. В случае проглатывания или случайного воздействия немедленно обратитесь за медицинской помощью.
| Символы опасности | Никто |
| Описание безопасности | Используйте при достаточной вентиляции. Избегайте контакта с кожей и глазами. Носите защитное снаряжение. |
| Идентификационные номера ООН | Непригодный |
| код ТН ВЭД | 28352200 |
| Класс опасности | Не классифицируется как опасный |
| Группа упаковки | Непригодный |
| Токсичность | Низкая токсичность. Проглатывание больших количеств может вызвать проблемы с желудочно-кишечным трактом. Может вызвать раздражение и ожоги при попадании на кожу и в глаза. |
Методы синтеза тринатрийфосфата
Существует несколько методов синтеза Na3PO4, в том числе реакция гидроксида натрия с фосфорной кислотой , реакция карбоната натрия с фосфорной кислотой и реакция хлорида натрия с фосфорной кислотой в присутствии карбоната натрия.
Распространенный метод включает реакцию гидроксида натрия (NaOH) с фосфорной кислотой (H3PO4) . В результате этой реакции образуется Na3PO4 (Na3PO4) и вода (H2O). Сбалансированное химическое уравнение этой реакции:
3 NaOH + H3PO4 → Na3PO4 + 3 H2O
Другой метод включает реакцию карбоната натрия (Na2CO3) с фосфорной кислотой (H3PO4) . В результате этой реакции образуется Na3PO4 (Na3PO4), углекислый газ (CO2) и вода (H2O). Сбалансированное химическое уравнение этой реакции:
Na2CO3 + 2 H3PO4 → 2 Na3PO4 + 3 CO2 + 3 H2O
Третий метод включает реакцию хлорида натрия (NaCl) с фосфорной кислотой (H3PO4) в присутствии карбоната натрия (Na2CO3) . В результате этой реакции образуется Na3PO4 (Na3PO4), хлорид натрия (NaCl), углекислый газ (CO2) и вода (H2O). Сбалансированное химическое уравнение этой реакции:
3 NaCl + H3PO4 + Na2CO3 → Na3PO4 + 3 NaCl + 3 CO2 + 3 H2O
Промышленность широко использует эти методы для производства Na3PO4 для различных целей.
Использование тринатрийфосфата
Na3PO4 имеет множество применений в различных отраслях промышленности благодаря своим уникальным свойствам. Некоторые распространенные применения Na3PO4:
- Пищевая промышленность: используется в качестве пищевой добавки для улучшения текстуры, вкуса и срока годности обработанных пищевых продуктов.
- Фармацевтическая промышленность: используется при производстве различных фармацевтических продуктов, в том числе слабительных, антацидов и растворов электролитов.
- Водоочистка: используется в процессах водоподготовки для контроля образования накипи и предотвращения коррозии в системах водоснабжения.
- Моющая промышленность: используется в производстве моющих средств для улучшения их чистящих свойств.
- Сельское хозяйство: используется в качестве удобрения и кондиционера почвы в сельском хозяйстве для обеспечения растений необходимыми питательными веществами.
- Промышленное применение: Используется в различных промышленных процессах, включая обработку поверхности металлов, производство керамики и в качестве антипирена.
- Лабораторное применение: используется в различных лабораторных целях, включая очистку ДНК и белков, буферные растворы и в качестве регулятора pH.
Вопросы:
Вопрос: Растворим ли Na3PO4 в воде?
Ответ: Да, Na3PO4 хорошо растворяется в воде.
Вопрос: Какова молярная концентрация ионов натрия в 0,350 М растворе Na3PO4?
А: В растворе 0,350 М Na3PO4 молярная концентрация ионов натрия равна 1,05 М.
Вопрос: Na3PO4 — это кислота или основание?
Ответ: Na3PO4 — основная соль.
Вопрос: Каково чистое ионное уравнение реакции между водными растворами Na3PO4 и CuSO4?
A: Итоговое ионное уравнение реакции между водными растворами Na3PO4 и CuSO4: 2Na+(вод) + Cu2+(вод) + 2PO43-(вод) + SO42-(вод) → Cu3(PO4)2(т) + 2Na+ (водный) + SO42-(водный).
Вопрос: Какой объем 3,50 М раствора Na3PO4 следует использовать для приготовления 1,50 л 2,55 М раствора Na3PO4?
Ответ: Чтобы приготовить 2,55 М раствор Na3PO4 с использованием 3,50 М раствора Na3PO4, вам потребуется использовать 0,921 л 3,50 М раствора.
Вопрос: Что такое тринатрийфосфат?
A: Тринатрийфосфат представляет собой неорганическую соль фосфата натрия с химической формулой Na3PO4.
Вопрос: Растворим ли тринатрийфосфат?
Ответ: Да, тринатрийфосфат хорошо растворим в воде.
Вопрос: Как узнать, является ли ваш белый порошок бикарбонатом натрия или тринатрийфосфатом?
Ответ: Один из способов отличить бикарбонат натрия от Na3PO4 — провести простой тест на pH. Бикарбонат натрия является основным и дает pH выше 7, тогда как Na3PO4 нейтрален и дает pH 7.
Вопрос: Какова формула тринатрийфосфата?
Ответ: Формула тринатрийфосфата: Na3PO4.
