Сульфит магния (MgSO3) представляет собой соединение, состоящее из ионов магния и сульфита. Он широко используется в качестве пищевого консерванта и антиоксиданта в пищевой промышленности.
| Название ИЮПАК | Сульфит магния |
| Молекулярная формула | MgSO3 |
| Количество CAS | 7757-88-2 |
| Синонимы | Сульфонат магния, триоксид серы магния, Е-536 |
| ИнЧИ | InChI=1S/Mg.H2O3S/c;1-4(2)3/h;(H2,1,2,3)/q+2;/p-2 |
Свойства сульфита магния
Формула сульфита магния
Сульфит магния имеет химическую формулу MgSO3, которая указывает на то, что он состоит из одного атома магния, одного атома серы и трех атомов кислорода. Сульфит-ион представляет собой многоатомный ион с формулой SO3 2-, состоящий из центрального атома серы, связанного с тремя атомами кислорода. Ион Mg имеет заряд +2, а ион SO3 2- имеет заряд -2, что делает соединение электрически нейтральным.
сульфит магния Молярная масса
Молярная масса MgSO3 составляет 104,37 г/моль, что соответствует сумме атомных масс одного атома магния, одного атома серы и трех атомов кислорода. Эта величина важна для расчета количества MgSO3, необходимого для той или иной реакции, а также определения стехиометрии химических уравнений.
Температура кипения сульфита магния
MgSO3 разлагается до достижения точки кипения, поэтому определенной точки кипения у него нет. Вместо этого он начинает распадаться на оксид магния и диоксид серы при температуре выше 700°C. Этот процесс разложения может быть ускорен под воздействием воздуха или влаги, что делает MgSO3 относительно нестабильным соединением.
Сульфит магния Температура плавления
Температура плавления MgSO3 составляет около 150°С. При этой температуре соединение начинает разлагаться на оксид магния и диоксид серы. Процесс разложения экзотермический, то есть с выделением тепла. Температура плавления MgSO3 важна для понимания его свойств твердого тела, таких как растворимость и кристаллическая структура.
Плотность сульфита магния г/мл
Плотность MgSO3 варьируется в зависимости от его физической формы, но обычно составляет от 2,5 до 3,0 г/мл. Эта величина важна для определения массы данного объема MgSO3, а также для понимания его поведения в растворе. Плотность MgSO3 также можно использовать для расчета его плотности, которая является мерой его относительной плотности по сравнению с водой.
Молекулярный вес сульфита магния
Молекулярная масса MgSO3 составляет 104,37 г/моль. Эта величина важна для понимания физических и химических свойств соединения, а также для расчета количества MgSO3, необходимого для той или иной реакции. Молекулярную массу MgSO3 можно рассчитать, сложив атомные массы одного атома магния, одного атома серы и трех атомов кислорода.
Структура сульфита магния
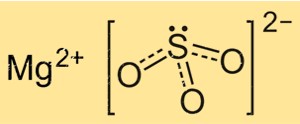
В основе структуры MgSO3 лежит кристаллическая решетка, состоящая из ионов Mg+2 и ионов SO32-. Ионы Mg+2 окружены шестью атомами кислорода, расположенными октаэдрически, а ионы SO32- связаны с ионами магния через два атома кислорода. Кристаллическая структура MgSO3 важна для понимания его физических и химических свойств, таких как растворимость и реакционная способность.
Растворимость сульфита магния
MgSO3 плохо растворяется в воде, его растворимость составляет около 7,5 г/л при комнатной температуре. Такая низкая растворимость обусловлена кристаллической структурой соединения, которая затрудняет проникновение и растворение молекул воды в твердом веществе. MgSO3 более растворим в кислых растворах, поскольку кислота может вступать в реакцию с сульфит-ионом с образованием бисульфита и сернистой кислоты. Растворимость MgSO3 важна для понимания его поведения в растворе, а также для определения его эффективности в качестве пищевого консерванта и антиоксиданта.
| Появление | Белый порошок или кристаллы |
| Удельный вес | 2,5 – 3,0 |
| Цвет | Белый |
| Запах | Без запаха |
| Молярная масса | 104,37 г/моль |
| Плотность | 2,5–3,0 г/мл |
| Точка плавления | Около 150°С |
| Точка кипения | Разлагается при температуре выше 700°C |
| Мигающая точка | Непригодный |
| Растворимость в воде | Мало растворим, примерно 7,5 г/л при комнатной температуре. |
| Растворимость | Лучше растворяется в кислых растворах |
| Давление газа | Непригодный |
| Плотность пара | Непригодный |
| пКа | Непригодный |
| рН | Непригодный |
Безопасность и опасность сульфита магния
MgSO3 не считается очень опасным веществом. Однако он может вызвать раздражение глаз, кожи и дыхательных путей при контакте или вдыхании. Проглатывание MgSO3 может вызвать раздражение желудочно-кишечного тракта и, возможно, рвоту. Длительное воздействие высоких концентраций может привести к повреждению легких или раздражению дыхательных путей. Поэтому важно обращаться с MgSO3 осторожно, используя соответствующие средства индивидуальной защиты и избегая вдыхания пыли и паров. MgSO3 следует хранить в прохладном, сухом, хорошо вентилируемом помещении вдали от несовместимых материалов, таких как сильные окислители, кислоты и основания.
| Символы опасности | Никто |
| Описание безопасности | Избегайте вдыхания пыли и паров. Носите соответствующие средства индивидуальной защиты. |
| Идентификационные номера ООН | Не регулируется |
| код ТН ВЭД | 2833,29 |
| Класс опасности | Не классифицируется как опасный |
| Группа упаковки | Непригодный |
| Токсичность | Низкая токсичность, может вызвать раздражение глаз, кожи и дыхательных путей при контакте или вдыхании. Проглатывание может вызвать раздражение желудочно-кишечного тракта и, возможно, рвоту. Длительное воздействие высоких концентраций может привести к повреждению легких или раздражению дыхательных путей. |
Методы синтеза сульфита магния
MgSO3 можно синтезировать различными методами, например, реакцией сернистой кислоты или сернистого газа с оксидом или гидроксидом магния.
В одном методе реакция оксида магния с водой образует гидроксид магния , который затем реагирует с сернистой кислотой с образованием MgSO3.
Другой метод включает реакцию гидроксида магния с сернистым газом в присутствии воды с образованием MgSO3.
Другой метод: при взаимодействии сульфата магния с сульфитом натрия или сульфитом калия можно синтезировать MgSO3. В результате этой реакции образуется осадок MgSO3, который исследователи могут выделить путем фильтрации и сушки.
Реакция ацетата магния с сернистым газом в присутствии воды позволяет получить MgSO3. Затем промойте и высушите образовавшийся осадок MgSO3.
Эти методы можно использовать для производства MgSO3 для различных целей, включая производство бумаги и целлюлозы, обработку продуктов питания и напитков, а также очистку воды.
Использование сульфита магния
MgSO3 находит различное применение в разных отраслях. Вот некоторые из его распространенных применений:
- Водоочистка: используется в качестве поглотителя кислорода при очистке котловой воды для предотвращения коррозии и образования накипи.
- Обработка пищевых продуктов и напитков: используется в качестве консерванта и антиоксиданта при обработке пищевых продуктов и напитков для продления срока годности и предотвращения порчи.
- Целлюлозно-бумажное производство: используется в качестве отбеливателя в целлюлозно-бумажной промышленности для улучшения белизны и цвета бумажной продукции.
- Текстильное производство: используется в качестве восстановителя в текстильном производстве для удаления избытка кислорода и улучшения качества готовой продукции.
- Сельское хозяйство: используется в качестве опрыскивания листьев для улучшения роста растений и повышения урожайности.
- Медицина: используется в традиционной медицине благодаря своим антиоксидантным и противовоспалительным свойствам.
- Косметика: используется в косметике в качестве эмульгатора, стабилизатора и регулятора pH.
- Другое применение: Также используется в производстве клеев, красок и покрытий, а также в процессах очистки сточных вод.
Вопросы:
Вопрос: Какова формула сульфита магния?
Ответ: Формула сульфита магния — MgSO3.
Вопрос: Сколько сульфита магния содержится в образце объемом 2,4 моля?
Ответ: В образце объемом 2,4 моля MgSO3 содержится 2,4 моля MgSO3.
Вопрос: Какова массовая доля каждого элемента в 1 моле сульфита магния?
Ответ: В одном моле сульфита магния массовая доля магния составляет 32,44%, серы — 29,44%, кислорода — 38,12%.
Вопрос: Останавливает ли сульфит магния мышечные судороги?
Ответ: Нет никаких научных доказательств того, что MgSO3 может остановить мышечные спазмы. Однако для этой цели использовался сульфат магния (английская соль).
Вопрос: Каков эффект добавления сульфита магния в реакции?
Ответ: Добавление MgSO3 может действовать как восстановитель в некоторых реакциях, удаляя кислород. В некоторых случаях он также может действовать как консервант и антиоксидант.
Вопрос: Является ли сульфит магния ионным или молекулярным?
Ответ: MgSO3 — ионное соединение.
